シアル酸は動物由来の糖タンパク質、糖脂質及びバクテリアに存在する多糖などの重要な構成成分であり、現在天然の糖タンパク質及び糖脂質において20種類以上の誘導体が知られている。 KDNは2-ケト-3-デオキシ-D-グリセロ-D-ガラクトノノン酸の略称で、新規なシアル酸である。KDNの構造はシアル酸の五位の炭素に結合しているアミノアシル基が水酸基で置換されたものである(図1)。  図1.KDN(a)とシアル酸(b)Neu5Ac(R=COCH3)とNeu5Gc(R=COCH2OH)の構造。 図1.KDN(a)とシアル酸(b)Neu5Ac(R=COCH3)とNeu5Gc(R=COCH2OH)の構造。 1986年灘野らがニジマス卵表層胞成分であるポリシアロ糖タンパク質(PSGP)分子中に微量成分としてKDN残基の存在を初めて見出して以来、ニジマス卵膜表面や雌体腔液にKDN含量の高い糖タンパク質が発見され、更に、バクテリアと両生類にもKDNの存在が報告された。これらの結果は、KDN残基はシアル酸と同様に様々な複合糖質の構成成分として生物界に広く分布していることを示唆しているが、1991年、私はニジマス精子に初めてKDNを含むガングリオシド、(KDN)GM3を発見し、KDNが糖脂質にも存在することを明らかにした[1]。 ガングリオシドはシアル酸を含むスフィンゴ糖脂質で、細胞膜に局在しており、その糖鎖が細胞間の相互作用や細胞表面での分子の認識に重要な役割を果たしている例が数多く報告されている。例えば、生理活性物質のレセプター機能、細胞増殖のモジュレーター、細胞接着、認識、免疫応答などへの関与、ニューロンシナプス伝達のレギュレーターとしての機能などが知られている。 精子表面に見出された(KDN)GM3はニジマス受精過程において機能を持つことが推測され、非常に興味深い。また、ニジマスにおける精子以外の細胞、組織にKDN-ガングリオシドの存在の有無およびもし存在するならばそれらの機能にも興味が持たれた。本研究はデアミノノイラミン酸(KDN)含有ガングリオシドの検出、構造および生物学的機能の解明を目指して行われ、結果は以下のように要約される。 (1)微量のKDN残基の検出及びその役割の解明に重要な道具として、KDN残基を特異的に認識するモノクローン抗体(mAb.kdn3G)を作製し、そのエピトープがKDN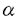 2→3Gal 2→3Gal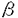 1→であることを明らかにした。 1→であることを明らかにした。 (2)mAb.kdn3G抗体を用いて、ニジマス体腔液中に、新たなKDN-ガングリオシドを見出し、その構造及び局在部位を明らかにした。 (3)ニジマス精巣中に、mAb.kdn3Gと反応する微量糖脂質成分を見出して、構造を決定した。また、これらの糖脂質が精子形成過程において時期特異的に発現することを明らかにした。 (4)ニジマス精子表面にある主要糖脂質成分である(KDN)GM3が、糖脂質Gg3と特異的に相互作用をすることを見出した。また、ニジマス精子も糖脂質Gg3と特異的に接着することを明らかにし、この相互作用か受精時に精子と卵との接着機構として働いている可能性を示唆した。 次に、研究方法および結果を具体的に記す。 まず、(KDN)GM3を用いて、KDN残基を特異的認識するモノクローン抗体を作製することに成功した。精製(KDN)GM3とSalmonella minnesota菌の混合物を免疫源として、BALB/cマウスを免疫した。血中における抗体価上昇時の脾臓細胞とP3U1マウスミエローマ細胞を用いてハイブリドーマを作成し、抗体陽性コロニーから限界希釈法によって単一クローンを得た。このクローンの分泌する抗体(mAb.kdn3G)は、IgG3であり、(Neu5Ac)GM3をはじめ各種Neu5Ac-ガングリオシドとは全く反応しなかった。また、KDN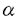 2→3Gal配列をもつKDN-糖タンパク質にも結合すること、いくつかのKDN含有オリゴ糖鎖による抗体と(KDN)GM3との結合阻害実験の結果から、mAb.kdn3GがKDN 2→3Gal配列をもつKDN-糖タンパク質にも結合すること、いくつかのKDN含有オリゴ糖鎖による抗体と(KDN)GM3との結合阻害実験の結果から、mAb.kdn3GがKDN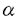 2→3Gal 2→3Gal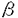 1→を特異的に認識することが分かった。 1→を特異的に認識することが分かった。 この抗体を用いて、雌雄ニジマスの様々な組織・臓器(脳、腎臓、肝臓、赤血球、筋肉、卵、体腔液、卵巣、精巣)に、KDN-ガングリオシド存在の有無を精査し、雌体腔液および雄精巣に幾つかのmAb.kdn3Gと反応する糖脂質を検出した。興味深く思われたのは、KDN残基を含む種々の複合糖質がいずれもニジマス生殖細胞に局在することであり、これらが受精及び初期胚発生過程において、特異的な細胞-細胞相互作用に関与する分子である可能性が考えられる。 次に、ニジマス雌体腔液に存在するmAb.kdn3Gと反応する糖脂質の構造を化学分析(組成分析、メチル化分析)、機器分析(FAB-MS測定と一次元、二次元プロトンNMR測定)、酵素消化(エンドグリコセラミダーゼとシアリダーゼ消化)および免疫化学的方法により、(KDN)GD1aと(KDN)GD1a(+OAc)であると決定した(図2)。また、これらのKDN-ガングリオシドは、どちらも可溶性画分には存在せず、特徴的な細胞、あるいは、顆粒画分に存在することを明らかにした。また、これらは排卵後の卵巣にも存在するが、卵形成過程における卵巣および排卵直前の卵巣には検出されなかったことから、(KDN)GD1aおよび(KDN)GD1a(+OAc)は排卵過程に関連して合成されると考えられる。  図2.(KDN)GD1aと(KDN)GD1a(+OAc)の全構造。 図2.(KDN)GD1aと(KDN)GD1a(+OAc)の全構造。 第三に、mAb.kdn3Gを用いて、新にニジマス精巣見出した(KDN)GM3以外の複数のKDN含有糖脂質の全構造を上述の方法によって、(KDN)GD1a、(KDN)GD1a、(KDN,Neu5Ac)GD1a、(KDN)GD1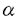 、および(KDN,Neu5Ac)GD1 、および(KDN,Neu5Ac)GD1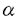 であると決定した(図3)。ニジマス精子形成過程における、これらのKDN含有ガングリオシドの発現量及び発現パターンをmAb.kdn3Gを用いたELISA法とTLC/Immunostaining法で調べた。まず、ELISA法で5月にはKDN-ガングリオシドが微量ながら検出され、その後発現量が増大し、排精直前(9月中旬)に最大となることが分かった。また、TLC/Immunostainingの結果から、(KDN)GM3、(KDN)GD1a、(KDN,Neu5Ac)GD1aは精子形成の全過程に存在しているが、(KDN)GD1 であると決定した(図3)。ニジマス精子形成過程における、これらのKDN含有ガングリオシドの発現量及び発現パターンをmAb.kdn3Gを用いたELISA法とTLC/Immunostaining法で調べた。まず、ELISA法で5月にはKDN-ガングリオシドが微量ながら検出され、その後発現量が増大し、排精直前(9月中旬)に最大となることが分かった。また、TLC/Immunostainingの結果から、(KDN)GM3、(KDN)GD1a、(KDN,Neu5Ac)GD1aは精子形成の全過程に存在しているが、(KDN)GD1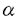 と(KDN,Neu5Ac)GD1 と(KDN,Neu5Ac)GD1 は時期特異的に発現され、成熟精子には(KDN)GM3のみが存在することが分かった。これらのことから、構造の異なるKDN-ガングリオシドが発現は時期特異的に制御されて発現されることが示唆された。 は時期特異的に発現され、成熟精子には(KDN)GM3のみが存在することが分かった。これらのことから、構造の異なるKDN-ガングリオシドが発現は時期特異的に制御されて発現されることが示唆された。  図3.(KDN)GD1a、(KDN,Neu5Ac)GD1a、(KDN)GD1 図3.(KDN)GD1a、(KDN,Neu5Ac)GD1a、(KDN)GD1 、と(KDN,Neu5Ac)GD1 、と(KDN,Neu5Ac)GD1 の構造。 の構造。 (KDN)GM3はニジマス成熟精子に最も多量に含まれるスフィンゴ糖脂質で、免疫染色の結果から、精子の頭部と尾部の膜表面に遍在することが明らかとなった。また、KDN残基を持つ分子は、自分同士、あるいは他の糖鎖と会合しやすい性質を持ち、このような性質がKDN-ガングリオシドの機能と密接に関係することが考えられた。そこで第四に、(KDN)GM3が受精過程において、精子と卵の認識・接着に関与する可能性を調べる目的で、(KDN)GM3 を含むリポソームと固相化糖脂質との結合実験を行った。その結果、(KDN)GM3を含むリポソームは糖脂質Gg3でコートしたプレートに強く結合し、この結合はMn2+の存在で増強され、EDTAの存在下では阻害されないことが明らかとなった(図4a)。また、(KDN)GM3を多量に発現しているニジマス精子を用いて、生理条件下で様々の糖脂質をコートしたプレートとの接着性を調べたところ、精子はGg3と特異的に結合し、この結合はモノクローン抗体mAb.kdn3Gによって阻害された(図4b)。更に、ニジマス卵膜及び細胞膜から抽出された複合糖質中にanti-Gg3モノクローン抗体mAb.2D4と反応する画分が見出された。これらの結果から、精子表面にある(KDN)GM3と卵細胞表面に存在するGg3と同一のエピトープ糖鎖を持つ複合糖質が受精過程において精子と卵の認識、接着に関与していることが示唆された。  図4.(a)(KDN)GM3を含むリポソームとGg3をコートしたプレートとの接着。Ca2+、Mg2+、とMn2+存在下(●);Ca2+とMg2+存在下(〇);二価陽イオンを含まない(■);二価陽イオンを含まず、EDTA存在下(□)。(b)精子とGg3をコートしたプレートとの接着。コントロールヤギIgG抗体で処理した精子( 図4.(a)(KDN)GM3を含むリポソームとGg3をコートしたプレートとの接着。Ca2+、Mg2+、とMn2+存在下(●);Ca2+とMg2+存在下(〇);二価陽イオンを含まない(■);二価陽イオンを含まず、EDTA存在下(□)。(b)精子とGg3をコートしたプレートとの接着。コントロールヤギIgG抗体で処理した精子( );mAb.kdn3Gで前処理した精子(■)。抗体で処理しない精子との接着を100%としたときの%値で示した。[1] Yu Song,Ken Kitajima,Sadako Inoue,and Yasuo Inoue(1991)J.Biol.Chem.266,21919-21935. );mAb.kdn3Gで前処理した精子(■)。抗体で処理しない精子との接着を100%としたときの%値で示した。[1] Yu Song,Ken Kitajima,Sadako Inoue,and Yasuo Inoue(1991)J.Biol.Chem.266,21919-21935. |