学位論文要旨
| No | 111256 | |
| 著者(漢字) | 松島,芳隆 | |
| 著者(英字) | ||
| 著者(カナ) | マツシマ,ヨシタカ | |
| 標題(和) | 生物活性セスキテルペン類の合成研究 | |
| 標題(洋) | Synthetic Studies on Biologically Active Sesquiterpenes | |
| 報告番号 | 111256 | |
| 報告番号 | 甲11256 | |
| 学位授与日 | 1995.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(農学) | |
| 学位記番号 | 博農第1547号 | |
| 研究科 | 農学生命科学研究科 | |
| 専攻 | 応用生命化学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 天然物の光学活性体合成においては、いかに光学的に純粋な出発物を入手するかが鍵となっている。その方法には、一般にキラルプール法、光学分割法、不斉合成法の三つの方法があるが、筆者の所属研究室では不斉の導入法として生化学的手法を多用してきた。例えばパン酵母による不斉還元反応を原料段階で用いることにより、有用な光学活性原料を調製し種々の天然物の合成に応用してきた。筆者はその中で最も高い光学純度で得られる 1.Pinthunamide(1):レタスの根の生長促進作用を有する物質として糸状菌Ampulliferina sp.から単離された代謝産物。 2.(E)-endo-bergamoten-12-oic acids [ 3.Homogynolide A(4):貯蔵穀物の害虫(Sitophilus granariusなど)に対する摂食阻害作用を有する植物成分。 それぞれの合成について順に説明する。まず1及び2,3の逆合成解析を行なった(Scheme 1)。これらは基本骨格としてピナン骨格を有しており、重要中間体として類似したラクトン5a及び5bを作ればいいことになる。また、これらは太線で示した結合を分子内アルキル化により形成させると考えるとトシラート6a、6bから導くことができる。これらは上記の対称ビシクロジケトンの酵母還元により得られる  それでは実際の合成について説明する(Scheme2)。ビシクロジケトン7の酵母還元により高い光学純度(99%e.e.以上)で得られる  次に鍵反応となる分子内アルキル化である(Scheme3)。塩基にリチウムヘキサメチルジシラジド[LiN(TMS)2]を用いて四員環と五員環ラクトンを同時に構築し、三環性のピナン骨格を有する5aを得ることに成功した。この際ラクトンの開環を経由して生成したと思われるエポキシニトリル9aが副産物として得られてきた。  基本骨格5aが得られたので残るは側鎖の形成である(Scheme4)。5aの二重結合を四酸化オスミウムで酸化してジオールとした後、保護基のつけ外しを経てSwern酸化し、アルデヒド10とした。このものにWittig-Horner反応を行ない炭素鎖を延長し、脱保護、酸化等を経て最後にアミド化し目的のpinthunamide(1)を得ることができた。合成した1の旋光度の符号が天然の(+)-pinthunamideと一致したことより絶対立体配置を図示のように決定することができた。  逆合成解析(Scheme2)の5bのラクトン部を開環、伸長していけばよい。5b以後の合成について説明する(Scheme5)。5bはLiAlH4還元により開環し、続いて保護基の脱着を経てSwern酸化、さらにWittig-Horner反応で炭素鎖を延ばして11へ導いた。二重結合に水素添加した後、TMS基を除去して12を得た。このものをTfCl-DMAPの条件により脱水しendo( 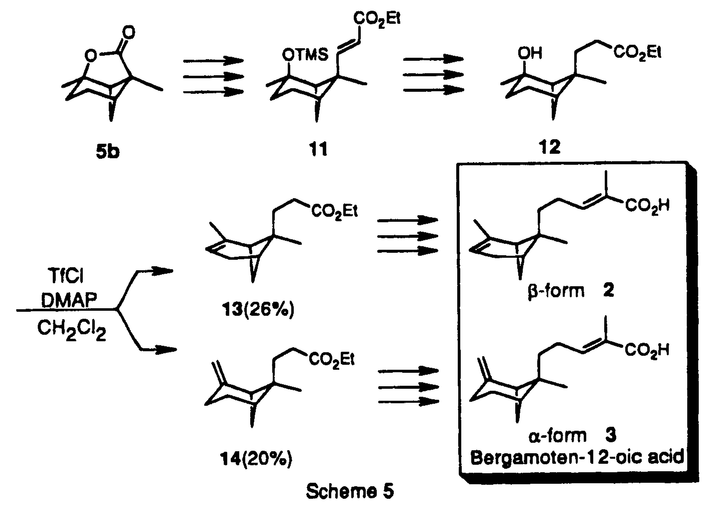 まず逆合成解析を行なった(Scheme6)。スピロラクトン部は15の左の部分の変換により合成できると考えた。また15の五員環は26の環縮小により形成できると考えられ、16は17のoxy-Cope転位反応を利用すると構築できると考案した。17は先程と同じ光学活性原料  まずoxy-Cope転位反応まで説明する(Scheme7)。Aより出発し、水酸基を保護し、メチル基導入後ケトン部をオレフィンに変換し18を得た。次に脱保護、Swern酸化し19とした。これにcis-1-プロペニル基を付加するとoxy-Cope転位の前駆体17となる。通常のGrignard反応では収率が低かったが有機セリウム試薬に変換することで収率を向上させることができた。当初、付加の選択性は立体的にすいた側から付加した望むendo体17が主生成物として得られると予想していた。しかしながらendo付加体とexo付加体の比は約3:4と悪く、しかもこれらは分離不能であった。収率は悪いながらもこれで前駆体17が合成できたので、次に鍵となるoxy-Cope転位を行なった。通常用いられるTHF、DME等の極性溶媒中では分解反応が主として起こってしまい非常に低収率であった(6%以下)が溶媒を極性の低いトルエンに変えることで27%まで向上させることができた。反応しないexo付加体は21%回収されている。これで右側の三つの不斉点の構築が終了した。  なお反応で生じたケトン部分は先の段階21で選択的に還元可能であることが既にわかっており、以上四つの不斉点については合成が終了したことになるので、残るは  以上、筆者は酵母還元産物である 1) Synthesis, 406(1993). (森 謙治教授と共著) 2) Synthesis, 417(1994). (森 謙治教授と共著) 3) Synthesis, in press. (森 謙治教授と共著) | |
| 審査要旨 | 本論文は、生物活性を有するセスキテルペン類の合成について論じたもので、三章よりなる。セスキテルペン類は、フェロモンや摂食阻害物質などの化学生態学的に興味の持たれるものを含め、様々な活性を有する生物活性化合物群であり、その構造決定、構造-活性相関など研究課題は多い。筆者はその構造の一般的な構築法を目指した合成研究を行なった。また、いずれの合成研究においてもパン酵母還元により高い光学純度で得られる 第一章では、レタスの根の生長促進作用を有する物質として糸状菌Ampulliferina sp.から単離されたセスキテルペンアミドpinthunamide(1)の合成とその絶対立体配置の決定について述べている。5のパン酵母還元により得られるAから出発し6→7の分子内アルキル化による四員環形成反応を鍵として、基本となるピナン骨格を構築し、続いて7の側鎖を延長するなどして目的のpinthunamideの合成を達成した。合成した1の旋光度の符号が天然の(+)-pinthunamideと一致したことより不明であった絶対立体配置を図示のように決定することができた。
第二章では、トマトなどの作物の害虫である蛾Heliothis zeaの雌に対する産卵刺激物質として野生トマトLycopersicon hirsutumの葉から単離されたセスキテルペンカルボン酸(E)-endo-bergamoten-12-oic acids[
第三章では、貯蔵穀物の害虫(Sitophilus granariusなど)に対する摂食阻害物質として単離されたバッカン類に属するセスキテルペンの一種homogynolide A(4)の合成について述べている。Aから出発し11→12のoxy-Cope転位を鍵反応として三つの不斉点をまず構築した。12の環縮小反応等を経て13とした後、五員環ラクトン部分を形成するなどして基本のバッカン骨格とし、最後にアンゲル酸エステル部を導入し、目的の(-)-homogynolide Aの合成を達成した。
以上本論文においては、酵母還元産物である | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/53853 |
 -ヒドロキシケトンAを共通の光学活性原料として、次に示した三種四つの天然物合成に利用して成果を得ることができたので報告する。
-ヒドロキシケトンAを共通の光学活性原料として、次に示した三種四つの天然物合成に利用して成果を得ることができたので報告する。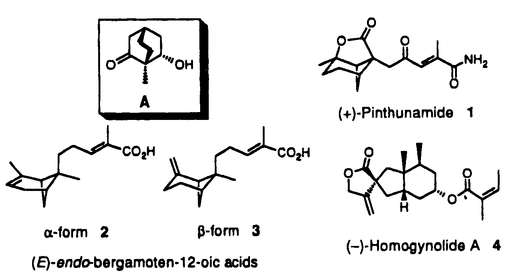
 -体(2),
-体(2),