学位論文要旨
| No | 111291 | |
| 著者(漢字) | 福田,博政 | |
| 著者(英字) | ||
| 著者(カナ) | フクダ,ヒロカズ | |
| 標題(和) | 接合伝達の分子機構:TraI helicase-endonucleaseの役割 | |
| 標題(洋) | Molecular Mechanism of DNA Transfer promoted by Sex Factor plasmid R100:Roles of the TraI endonuclease/helicase | |
| 報告番号 | 111291 | |
| 報告番号 | 甲11291 | |
| 学位授与日 | 1995.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(農学) | |
| 学位記番号 | 博農第1582号 | |
| 研究科 | 農学生命科学研究科 | |
| 専攻 | 応用生命工学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 細菌における有性生殖に相当する接合伝達は、いわゆるF型プラスミドと呼ばれる一連の性決定因子の一つであるFやR100などのDNAが、これを持つ雄の細菌から持たない雌の細菌へと移動する現象であり、このときDNA複製を伴い、最終的には供与菌、受容菌双方ともこのプラスミドを保持することになる。これらのプラスミドは、ある頻度で染色体に組み込まれ、その際、染色体DNAが伝達されることになり、結果として受容菌内で遺伝子の組換え体が生じる。この接合伝達による組換えは、1946年にLederbergとTatumによって初めて大腸菌において報告されて以来細菌の遺伝学的解析に用いられ、そこからオペロン説、レプリコンモデルなどが生まれるなど、今日の分子遺伝学の発展のきっかけを作った。 R100は、Fとともにそのtra遺伝子の解析が最も進んでいる伝達性プラスミドであり、R100上には20以上のtra遺伝子が約34キロ塩基対に及ぶ領域に遺伝子群をなして存在することが明らかにされている。tra遺伝子はその機能によって、性繊毛の形成、接合対の安定化、表面排斥、tra遺伝子の発現制御、DNAの移動、の5つに分類することができる。このうちDNAの移動に関わるものとしてはtraM、traY、traD、traIがあり、また、シスエレメントとしてDNA伝達開始点(oriT)及びその周辺領域(oriT領域)がDNAの移動に必須である。DNAの移動はプラスミド特異的なエンドヌクレアーゼがoriTにDNA鎖及び部位特異的にニックを導入することにより開始されると考えられているが、これまでに遺伝学的研究からtraIとtraYの二つの遺伝子産物がこのニッキング反応に必須なことが示され、エンドヌクレアーゼを構成することが示唆されてきた。最近、我々の研究室の稲本らは、精製したTraYタンパク質とTraIタンパク質を過剰生産した菌体の細胞破砕液を用いたcell-free systemにより、oriT領域を運ぶプラスミドにDNA鎖及び部位特異的にニッキングが起こることを示した。 本研究は、プラスミドR100のTraIタンパク質を精製し、purified systemでのニッキング反応の詳細な解析を行うことを最初の目的とし、それを足がかりにDNA伝達の分子機構を解明することを最終目標として行ったものである。 R100のTraIタンパク質をSDS-ポリアクリルアミドゲル上でのバンドを指標に三種のカラム・クロマトグラフィーにより99%の純度にまで精製した。traI遺伝子の塩基配列から予想されるTraIタンパク質のアミノ酸配列中にはDNAへリカーゼのモチーフ配列が存在することからTraIがヘリカーゼであることが予想されていたが、実際にこの精製標品はATPおよびMg2+依存性DNAへリカーゼ活性を有することが示された。さらにMg2+存在下で、TraIタンパク質は単独でoriTを運ぶプラスミドにニックを導入するようなDNA鎖及び部位特異的エンドヌクレアーゼ活性を持ち、ニッキング反応の産物として、ニックの5’末端とTraIタンパク質が共有結合した複合体が形成されることを示した。また、TraIタンパク質によるニッキング反応が、TraYタンパク質及び宿主タンパク質integration host factor(IHF)により促進されることを明らかにした。TraYタンパク質及びIHFはoriT領域内に特異的に結合することがすでに我々の研究室で明らかにされているので、実際のin vivo反応では、これらの三種のタンパク質がoriT付近に結合して複合体を形成することにより、効率よくニックを入れているのではないかと想像された。 TraIタンパク質をそのエンドヌクレアーゼ活性を指標に新たに4種のカラム・クロマトグラフィーにより精製し、完全にhomogeneousな標品を大量に得た。精製した標品のN末の数アミノ酸残基を決定したところ、塩基配列から予想されたtraI遺伝子のORFの開始コドンからのアミノ酸配列と一致したことから、TraIのN末は化学修飾もプロセシングも受けていないことがわかった。精製したTraIはゲルろ過によりストークス半径が63Å、沈降係数が6.7Sと決定され、これらの値から、分子量が186,000のロッド状の分子であることが分かった。ところが、低塩濃度下では沈降係数が8.9SにシフトすることからTraIの二量体化が示唆された。そこで、ケミカルクロスリンキングによる解析を行うことによって、TraIが実際に一量体と二量体との間で平衡状態で存在すること、塩濃度が低いほど二量体化が進むことが示された。ニッキング及び二本鎖解離反応は低塩濃度下で効率よく起こったことから、TraIニッケース・ヘリカーゼの活性型は二量体であると考えられた。また化学量論的解析からもTraIヘリカーゼの活性型は二量体であることが支持された。基質として、超らせんDNAの代わりに制限酵素で切断した線状DNA、またはTopoisomerase I処理したrelaxed circular DNAを用いた場合、全くニッキングが起きないか、その効率が著しく低下したことなどから、TraIのニッキングにはDNAの超らせん構造が必要なことが示された。欠失変異を導入した基質を用いた実験から、TraIによるニッキングに必要な領域がニック部位を含む54bpに限定された。 TraIタンパク質の新たな活性として、一本鎖DNAを二本鎖DNAのニッキングの場合と同一の位置で切断する一本鎖DNA特異的エンドヌクレアーゼ活性及びその切断位置で再結合させる活性を見いだした。一本鎖切断で生じた産物は、二本鎖の場合と同様、切断部位の5’端にTraIタンパク質が共有結合したものであり、再結合反応により取り除かれた。一本鎖切断に必要なTraIの認識領域を、切断部位を含む領域に置換変異を導入したものを基質として用いた実験によって、切断部位を含む約14ntの配列であることを明らかにしたが、この領域は、置換変異を導入した超らせんプラスミドDNAを基質とした実験で得られた二本鎖DNAのニッキングに必要な部分とほぼ一致することが分かった。また、DNase I footprintingの実験からTraIタンパク質は一本鎖DNA上のこの部分に特異的に結合することが示された。一方、超らせん二本鎖DNAを用いたKMnO4フットプリンティングの解析から、TraIが切断部位周辺を局所的に解離させること、またTraIの認識領域を部分的に一本鎖にしたものを基質とした場合、効率良く切断したことから、TraIによるニッキングが、二本鎖DNAを局所的に解離し、生じた一本鎖DNAを本質的に認識し、切断すると考えられた。本研究で見いだしたTraIの一本鎖DNAの切断と再結合活性は、DNA伝達の開始反応に与っているばかりではなく、供与菌体内でプラスミドのローリングサークル型複製が一周したところで再び生じる一本鎖DNA上のoriTを切断し、生じた3’端と既に切断されていた元のDNAの5’端とをTraIがつなぎ換えることによってプラスミド一単位を正確に作り出す活性であり、DNA伝達の終結に関与していると考えられた。 F型プラスミドのDNA伝達に関して本研究における結果及びこれまでに得られている知見から、我々は、現在次のようなモデル(図参照)を考えている。(1)DNA伝達はTraIのエンドヌクレアーゼ活性によりoriTにニックが入ることにより開始する。このニッキング反応はTraYタンパク質とIHFにより促進される。(2)TraIのDNAへリカーゼ活性によりニックの位置から二本鎖DNAは巻き戻されて一本鎖DNAが生じる。(3)接合の際、一本鎖の5’側から受容菌へ伝達されることが示されているが、ニッキングで生じた5’末端はTraIタンパク質と共有結合していること、F型プラスミドの伝達ではDNA以外にタンパク質の受容菌への移動はないことから、TraIタンパク質は供与菌内に残っており、従っておそらく5’端に近い一本鎖DNAがループ状で受容菌へ移行するのではないかと想像される。(4)一本鎖伝達と同時に供与菌側ではニックの3’末端をプライマーとしたローリングサークル型の複製が始まり、受容菌側では伝達されたプラスミド上に存在するssi部位におけるプライミングが起こり、ラギング鎖型の複製が行なわれる。(5)ローリングサークルが一周したところで、TraIはtransfer strand中の再び現われるoriTのところで切断し、生じる3’端とすでにTraIと結合した状態で存在する5’末端とつなぎ換えが起こり、正確な一単位のプラスミドDNAが作り出され、DNAの伝達が終結する。 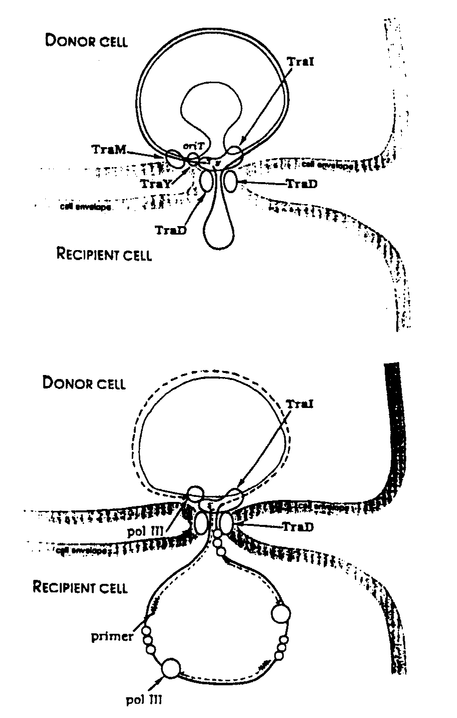 DNA伝達に関して、DNAヘリカーゼ以外にDNA移動の駆動力となる"モータータンパク質"の候補がないことから、これがDNA移動の駆動力となって一本鎖DNAを受容菌に押し込むと想像されているが、これに関しては全くわかっていない。現在、DNA伝達に必要な遺伝子traDの産物であるTraDタンパク質の精製を進めているが、TraDタンパク質はTraIカラムにトラップされることから、TraDタンパク質とTraIタンパク質は会合して複合体を形成することが示唆される。また、TraDはATPase活性を有することが示され、このTraDタンパク質がDNA移動の駆動力となる可能性もある。さらに、TraDは膜タンパク質であり、一本鎖DNAと親和性があることが示唆されていることから、TraDはDNA伝達の通り孔を形成すると考えられる。伝達される一本鎖DNAの5’端に結合しているTraIはTraDと会合することによって膜に固定されて一本鎖DNAを受容菌へと押し込んでいるのではないかと想像される。 | |
| 審査要旨 | 細菌の有性生殖に相当する接合伝達は,性決定因子と呼ばれるプラスミド,FやR100,などのDNAが,これを持つ細菌(雄)から持たない細菌(雌)へと移動する現象である。DNAの移動は,エンドヌクレアーゼがDNA伝達開始点(oriT)にプラスミドDNA鎖及び部位特異的にニックを導入することにより開始されると考えられていた。これまでにR100のコードするTraY,TraI両タンパク質を過剰生産した菌体の細胞破砕液を用いた無細胞糸により,oriT領域を運ぶプラスミドにDNA鎖及び部位特異的にニッキングが起こることが示されていた。本研究は,R100のTraIタンパク質を精製し,TraIによるニッキング反応の詳細な解析を行い,DNA伝達の開始と終結の分子機構を解明することを目的として行ったものである。 まず,TraIタンパク質をSDS-ポリアタリルアミドゲル上でのバンドを指標に精製した。得られた標品は,Mg2+存在下でoriTにニックを導入するようなDNA鎖及び部位特異的エンドヌクレアーゼ活性な持ち,産物としてニックの5’未端とTraIが共有結合した複合体が形成されることが示された。また,このニッキング反応が,TraYタンパク質及び宿主タンパク質IHFにより促進されることが示された。TraY及びIHFはoriT領域内に特異的に結合することから,in vivoではこれらの三種のタンパク質がoriT付近に結合して高次構造体な形成し,効率よくニックを入れるという可能性が指摘された。さらに,TraIが,ATP及びMg2+依存性DNAヘリカーゼ活性を有することが示され,TraIがニックの位置からDNAを巻き戻し一本鎖DNAを作り出す役目も担うことが示唆された。 続いて,TraIをそのエンドヌクレアーゼ活性を指標に新たに4種のカラム・クロマトグラフィーにより大量に精製した。得られたTraIのストークス半径は63Å,沈降係数は6.7Sと決定され,分子量が186,000のロッド状の分子であることが示唆された。ケミカルクロスリンキングによる解析からTraIは一量体と二量体との間で平衡状態で存在し,低塩濃度下で二量体化が進むことが示された。ニッキング及び二本鎖解離反応は低塩濃度下で効率よく起こり,従って,TraIの活性型が二量体であることが示された。基質として,超らせんDNAの代わりに線状,またはrelaxed circular DNAを用いた場合,TraIのニッキングの効率が著しく低下したことから,ニッキングにDNAの超らせん構造が必要なことが示された。欠失及び置換変異を導入した基質を用いた実験から,ニッキングに必要な領域がニック部位を含む18bpに限定された。 さらに,TraIタンパク質が,一本鎖DNAをニッキングの場合と同一の位置で切断するエンドヌクレアーゼ活性,及びその切断位置で再結合させる活性な持つことを見いだした。生じた産物は,ニッキングの場合と同様,切断部位の5’端にTraIタンパク質が共有結合したものであり,再結合反応によりTraIは取り除かれた。一本鎖切断に必要なTraIの認識領域は,oriT領域の切断部位を含む約14ntであり,二本鎖DNAのニッキングに必要な部分とほぼ一致することが示された。また,DNaseIフットプリンティングの実験からTraIは一本鎖DNA上のこの部分に特異的に認識することが示された。一方,超らせん二本鎖DNAを用いたKMnO4フットプリンティングの解析により,TraIが切断部位周辺を解離させることが示され,TraIによるニッキングが,二本鎖DNAを局所的に解離し,生じた一本鎖DNAを認識し切断する反応と考えられた。TraIの一本鎖DNAの切断と再結合活性は,DNA伝達の開始反応に関わっているばかりではなく,供与菌体内でR100プラスミドのローリングサークル型複製が一周したところで再び生じる一本鎖DNA上のoriTを切断し,生じた3’端と既に切断されていた元のDNAの5’端とをTraIがつなぎ換えることによってプラスミドー単位を正確に作り出す活性であり,DNA伝達の終結に関与していると考えられた。 以上本論文は,プラスミドR100のTraIタンパク質を精製し,purified systemでのニッキング反応の詳細な解析を行い,DNA伝達の開始・終結の分子機構を解明したものであり,学術上貢献するところが少なくない。よって審査員一同は,申請者に博士(農学)の学位を授与してしかるべきものと判定した。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/53855 |