| 内容要旨 | | 好アルカリ性バチルス属細菌Ya-B株の生産するアルカリ性エラスターゼは最適pH11.5、pI10.6、分子量26,000のセリンプロテアーゼである。結合組織に多いエラスチンをよく分解することから食肉軟化剤などとしての応用が期待されている。構造遺伝子のクローン化と塩基配列の決定からアルカリ性エラスターゼはサチライシンBPN’と55%のホモロジー持つサチライシン族の一員であることが分かり、サチライシンYa-Bとも呼んでいる。本酵素はまず分泌過程で推定27アミノ酸より成るシグナルペプチドが切断され、351アミノ酸より成るプロ体として分泌され、さらに推定83アミノ酸より成るプロ配列が切断されて成熟体サチライシンYa-Bになる。 すでにサチライシンBPN’においては、プロ配列が正しい立体構造の形成のためのガイド配列になっていること、またプロ体が成熟型酵素に対し特異的で強い阻害活性を持つことが知られており、プロ配列の機能、プロ体の構造に興味が集まっている。一方、Lysobacter enzymogenes495の生産するトリプシン型酵素 -リティクプロテアーゼの例では、大腸菌内でプロ配列と成熟体部分を別個のポリペプチドとして同時に発現させても、活性型 -リティクプロテアーゼの例では、大腸菌内でプロ配列と成熟体部分を別個のポリペプチドとして同時に発現させても、活性型 -リティクプロテアーゼとなり、プロ配列がなければ、活性型にはならないことが示され、この酵素の場合もプロ配列が成熟体酵素の活性発現に重要な役割を果たしていることが示されている。しかしサチライシンの系では同様にプロ配列と成熟体ポリペプチドを同時分離生産する方式では活性型のサチライシンは得られていない。 -リティクプロテアーゼとなり、プロ配列がなければ、活性型にはならないことが示され、この酵素の場合もプロ配列が成熟体酵素の活性発現に重要な役割を果たしていることが示されている。しかしサチライシンの系では同様にプロ配列と成熟体ポリペプチドを同時分離生産する方式では活性型のサチライシンは得られていない。 サチライシンBPN’については活性中心を形成するアミノ酸の一つAsp32をAsnに変えた変異体ではプロ体が蓄積することから、自触作用によりプロ配列が切断されることが明らかになっていた。しかし、理由は不明であるがプロ体は膜結合型であり多量に蓄積させることができず、サチライシンのプロ体の構造はまだ明らかにされていない。 このような状況のもとで、本研究はサチライシンYa-Bを材料とし、1)プロ配列と成熟体ポリペプチドを枯草菌内で同時・分離生産をさせて活性型のサチライシンYa-Bの分泌生産が可能かどうか、即ちプロ配列をトランスに供給しても活性型酵素が得られるかどうか、2)もし可能なら活性中心残基の一つSer214をCysに変えたチオールサチライシンYa-Bが同様にして分泌生産させることが出来るかどうか、3)上記の活性中心残基Ser214をCysに変換した変異体を分離方式でなくそのまま発現させればプロ体を蓄積させることが出来るかどうか、出来るとすればその構造はどのようになっているのかを明らかにする、ことを目的として行った。 1.サチライシンYa-Bのプロ配列と成熟体ポリペプチドの同時・分離生産 いまだにサチライシン族の酵素では、プロ配列と成熟体ポリペプチドの同時・分離生産で活性型酵素を得たという報告がない。そこで枯草菌を宿主とし、図1のような遺伝子構築をもつプラスミドを枯草菌DB104に導入した。 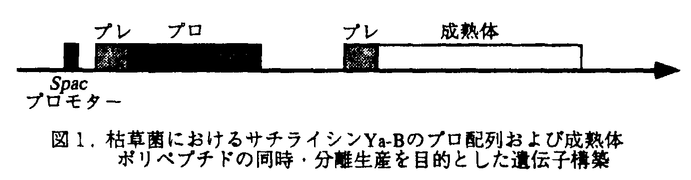 図1.枯草菌におけるサチライシンYa-Bのプロ配列および成熟体ポリペプチドの同時・分離生産を目的とした遺伝子構築 図1.枯草菌におけるサチライシンYa-Bのプロ配列および成熟体ポリペプチドの同時・分離生産を目的とした遺伝子構築 プロモーターはIPTGで誘導可能なspacを用いて、二つの遺伝子が同時に発現出来るようにしてある。プレ配列はサチライシンYa-Bのものである。宿主である枯草菌DB104は、2種の主要菌体外プロテアーゼ、即ちアルカリ性プロテアーゼとメタルプロテアーゼを欠損した変異株である。このような遺伝子構築を持ったプラスミドを持つ枯草菌DB104はIPTGで誘導した時のみ、形質転換株のコロニーはスキムミルクプレート上でハローを形成した。IPTGの非存在下、あるいは、プレ・プロ遺伝子の存在しないような構築にあってはハローは形成されなかった。この結果はサチライシン類としてははじめて、プロ配列と成熟体ポリペプチドの同時・分離生産によっても活性型酵素の分泌生産に成功したもので、プロ配列はトランスにも機能すること、また活性発現にはプロ配列が必須であることを直接示すことが出来た。 同時・分離生産で活性発現に成功したが、ハロー形成した形質転換体の培養濾液を用いてエラスターゼ特異的基質Succinyl-Ala-Ala-Ala-pNAの分解活性を調べたが、その分解活性が低いことや、また抗サチライシンYa-B抗体で検出した活性型成熟体が少ないため、ウエスタンブロッティングによって菌体内の生産物の解析を行った。その結果、枯草菌菌体内にプレ・成熟体が多量蓄積し封入体を形成していることが判明した。即ちプロ配列と成熟体ポリペプチドの同時・分離生産では会合の効率が悪く、多量に出来たプレ・成熟体が不溶化して菌体内に蓄積したものと考えられる。活性型の成熟型酵素を効率よく多量に分泌させるためには、更に生産条件の検討、適当な分子シャペロンの供給などが必要であろう。 同時・分離生産方式でまがりなりにも活性型サチライシンYa-Bの分泌生産に成功したが、ウエスタンブロッティングで調べたところ、同様の方式によってもチオールサチライシンYa-Bの生産には成功しなかった。その理由は明らかでないが、Ser214Cys体の方が不安定と考えられる。 2.大腸菌におけるサチライシンYa-Bのプロ体の発現 サチライシンのプロ配列が活性型酵素の立体構造形成に必須であることが従来、色々の実験で示されながら、サチライシンのプロ体の構造は未だに明らかになっていない。そこでサチライシンYa-Bでプロ体の蓄積を試みる目的で、Ser214をCysに変えた変異株(Cys置換型)をまず大腸菌で発現させることを試みた(図2参考)。 (A)はCys置換型プロ体をIPTGで誘導可能なspacプロモーターで発現させるための構築でプレ部分はサチライシンYa-B自体のプレ配列を用いている。(B)はCys型プロ体を大腸菌アルカリ性ホスファターゼプロモーターで発現させるための構築で、リン酸欠乏の培地で誘導合成出来る。またシグナルペプチド部分もアルカリ性ホスファターゼのものを用いており、これらの構築は当研究室で以前に開発されていたphoAを用いた大腸菌用の分泌ベクター活用したものである。 図2、(A)(B)の構築で、大腸菌の生産物をウエスタンブロッティングで調べたところ、いずれの場合も52kDaのサチライシンYa-B関連分子の生成を認めた。この分子種はCys置換型でなくても本来のSer型でも生成が認められた。この52kDaの局在場所を調べたところ、膜画分ないしはdebrisであり、ペリプラズム空間には認められなかった。52kDa蛋白を抗体カラムで分離精製し、N-末端アミノ酸配列の解析を行ったところN-末端はブロックされており、決定出来なかった。またV-8プロテアーゼ分解フラグメントについてもアミノ酸配列の決定を試みたが、試料の純度に問題の有ることが判明した。プロ体の想定分子量は36.6kDaであり、52kDaとはかけ離れており、このものがプロ体であるのかどうか判定しにくい状態となった。そこでプロ体を枯草菌で生産させてみることにした。 3.枯草菌におけるサチライシンYa-Bのプロ体の発現 枯草菌においてもCys置換型プロ体を生産分泌させるため、図2-(A)の構築の遺伝子を枯草菌DB104株に導入しIPTG誘導下にどのような産物が分泌されるかを調べた。DB104を用いる限りは、大腸菌で認められた52kDaの分子量を持つ生産物はウエスタンブロッティングで、培養液中には見出せなかった。そこで宿主を枯草菌WB600に変えてみた。これはDB104を土台とし、更に菌体外プロテアーゼ4種類を欠損した菌体外プロテアーゼに関する6重欠損変異株である。このものを宿主としてウエスタンブロッティングで調べたところ、培養液中に再び52kDaの分子量をもつサチライシンYa-B関連分子の生成を認めた。勿論、本来のSer型遺伝子ではWB600でも52kDaの分子種を検出することは出来なかった。遺伝子構築からいってこの52kDaの分子種はCys型のプロ体と考えられるので、この分子種を微量の活性型サチライシンYa-Bと温置したところ、徐々に52kDaの分子種は成熟型サイズ分子種(26kDa)に移行した。従ってこれは、まちがいなくプロ体であることが判明した。またこの成熟型はチオールサチライシンYa-Bそのものであると考えられる。これで、サチライシン類としてははじめてプロ体(但しCys置換型)を分泌生産させることに成功した。前述したようにサチライシンBPN’においてはプロ体は膜結合であると報告されている。しかし想定される分子量36.6kDaよりも大幅に大きいみかけの分子量(52kDa)を示すことから、この前駆体はなにか特殊な構造をとっているのではないかと想像される。そのことを明らかにすべく現在抗体カラムクロマトグラフィーを行いこの分子種を集め、N-末端およびV-8プロテアーゼ分解フラグメントのアミノ酸配列を決めることを試みている。Cys置換型プロ体はSer214Cysである以外は他にCys残基はなく分子内でS-S結合を作っている可能性はなく、また -メルカプトエターノル存在下でゲル電気泳動を行っており、分子間のS-S結合で異常な泳動速度を示しているわけでもない。 -メルカプトエターノル存在下でゲル電気泳動を行っており、分子間のS-S結合で異常な泳動速度を示しているわけでもない。  図2.大腸菌におけるサチライシンYa-B(Ser214Cys)のプロ体発現のための構築おわりに 図2.大腸菌におけるサチライシンYa-B(Ser214Cys)のプロ体発現のための構築おわりに サチライシンのプロ配列の機能の研究は広く行われているがこれらはサチライシンBPN’、サチライシンE関係に限られている。本研究ではエラスチンをよく分解するサチライシンYa-Bを材料とし、サチライシン類としてははじめて、1)枯草菌宿主においてプロ配列と成熟体ポリペプチドの同時・分離生産により、活性型酵素の分泌生産に成功し、2)またCys置換型プロ体が見かけの分子量の52kDaというような異常な構造をもつ分子であることを示唆した。これらはまだ研究の発端をつかんだんにすぎないが、さらにこれらの研究を進展させることでサチライシン類のプロ配列機能の研究に寄与出来ると考えている。 |
| 審査要旨 | | 好アルカリ性バチルス属細菌Ya-B株の生産するアルカリ性エラスターゼは最適pH11.5で分子量26,000のエラスチンをよく分解するセリンプロテアーゼである。構造遺伝子のクローン化と塩基配列の決定からアルカリ性エラスターゼはサチライシンBPN’と55%のホモロジー持つサチライシン族の一員であることが分かり,サチライシンYa-Bとも呼べる。本酵素はまず分泌過程で推定27アミノ酸より成るシグナルペプチドが切断され,351アミノ酸より成るプロ体として分泌され,さらに推定83アミノ酸より成るプロ配列が切断されて成熟体サチライシンYa-Bになる。すでにサチライシンBPN’においては,プロ配列は自触作用で切断されること,プロ配列が正しい立体構造の形成のためのガイド配列になっていること,またプロ体が成熟型酵素に対し特異的で強い阻害活性を持つことが知られており,プロ配列の機能,プロ体の構造に興味が集まっている。本論文はサチライシンYa-Bを材料とし,プロ配列の機能とプロ体の構造を明らかにするために行なわれた研究をまとめたもので以下の4章よりなる。 第1章は序論にあてられている。第2章はサチライシンYa-Bのプロ配列と成熟体ポリペプチドの同時・分離生産に関するものである。いまだにサチライシンでは,プロ配列と成熟体ポリペプチドの同時・分離生産で活性型酵素を得たという報告がない。そこで枯草菌を宿主とし,その目的にかなう遺伝子構築をもつプラスミドを枯草菌DB104に導入した。プロモーターはIPTGで誘導可能なspacを用いて,プレ・プロおよびプレ・成熟体ポリペプチドをコードする二つの遺伝子が同時に発現出来るようにした。プレ配列はサチライシンYa-Bのものである。宿主である枯草菌DB104は,2種の主要菌体外プロテアーゼ,即ちアルカリ性プロテアーゼとメタルプロテアーゼを欠損した変異株である。このような遺伝子構築を持ったプラスミドを導入した枯草菌DB104はIPTGで誘導した時のみ,形質転換株のコロニーはスキムミルクプレート上で分泌されたサチライシンYa-Bに起因するハローを形成した。IPTGの非存在下,あるいは,プレ・プロ遺伝子の存在しないような構築にあってはハローは形成されなかった。この結果はサチライシン類としてははじめて,枯草菌内でプロ配列と成熟体ポリペプチドの同時・分離生産によっても活性型酵素の分泌生産に成功したもので,プロ配列はトランスにも機能すること,また活性発現にはプロ配列が必須であることを明らかにした。しかし同様の方法によっても活性中心のSer214をCysに変換したチオールサチライシンYa-Bの生産には成功しなかった。 第3章は大腸菌におけるサチライシンYa-Bのプロ体の生成に関するものである。サチライシンのプロ配列が活性型酵素の立体構造形成に必須であることが従来,色々の実験で示されながら,サチライシンのプロ体の構造は未だに明らかになっていない。そこでサチライシンYa-Bでプロ体の蓄積を試みる目的で,Ser214をCysに変えた変異株(Cys置換型)をまず大腸菌で発現させることを試みた。spacあるいはphoAプロモーターを用いた発現系で大腸菌での生産をウエスタンブロッティングで調べたところ,いずれの場合も52kDaのサチライシンYa-B関連分子の生成を認めた。この分子種はCys置換型でなくても本来のSer型でも生成が認められた。52kDa蛋白質の局在場所を調べたところ,膜画分ないしはdebrisであった。 第4章は枯草菌におけるサチライシンYa-Bのプロ体の生成に関するものである。Cys置換型プロ体を生産させるため,大腸菌の場合と同様のspacプロモーターで発現するプラスミドを枯草菌DB104株に導入しIPTG誘導下にどのような産物が分泌されるかを調べた。DB104を用いる限りは,大腸菌で認められた52kDaの分子量を持つ生産物はウエスタンブロッティングで,培養液中には見出せなかった。そこで宿主を枯草菌WB600(DB104から更に菌体外プロテアーゼ4種類を欠損した菌体外プロテアーゼに関する6重欠損変異株)に替えてみたところ,培養液中に再び52kDaの分子量をもつサチライシンYa-B関連分子の生成を認めた。この分子種を微量の活性型サチライシンYa-Bと温置したところ,徐々に52kDa分子は成熟型サイズ分子種(26kDa)に移行した。従ってこれは,まちがいなくプロ体であることが判明した。これで,サチライシン類としてははじめてプロ体(但しCys置換型)を分泌生産させることに成功した。しかし想定される分子量36.6kDaよりも大幅に大きいみかけの分子量,52kDaを示すことから,この前駆体は何か特殊な構造をとっているのではないかと想像される。 以上本論文はサチライシンYa-Bにつきプロ配列と酵素本体とを同時・分離生産させ活性ある酵素の分泌生産に成功しin uivoの生産でプロ配列が蛋白質の構造決定にトランスにも機能しうることをしめし,さらにSer214をCysに変換したCys置換型のプロ体を分泌生産させることに成功し,しかもプロ体は異常構造をとっていることを示唆したもので学術上貢献するところが少なくない。よって審査員一同は本論文が博士(農学)論文として価値あるものと認めた。 |