| 内容要旨 | | 放線菌は種々の抗生物質をはじめとする多種多様な二次代謝産物を生産する点で産業上非常に有用な菌群である。さらに放線菌は、固体培地上で基底菌糸から気菌糸・胞子への形態分化を行う。原核生物のなかで最も複雑な形態分化を示す放線菌は、それが生物分化に関する基礎的な研究の上でも格好の材料であることを示しており、二次代謝同様、この菌群の形態分化に着目した分子レベルの解析は非常に重要である。 Streptomyces griseusはストレプトマイシンや黄色色素等の二次代謝産物を生産するとともに、基底菌糸から気中菌糸を伸張し、白色の直鎖状胞子への分化を行う。この菌のこれらの形質は菌自身の生産する微生物ホルモン、A-ファクターによって正に制御されている。放線菌の2つの互いに密接な、しかし性質の大きく異なる側面-二次代謝と形態分化-を同時に誘導するA-ファクターの興味深い性質に基づき、これまでにその制御機構に関する分子レベルでの精力的な研究がなされてきた。本研究はS.griseusのA-ファクター欠損株がそのために栄養菌糸から気中菌糸への形態分化を開始できない性質を示すことに着目し、この株にプラスミド上で導入することでそれ単独で形態分化能を回復させる遺伝子を取得し、その解析を通じてこの菌の形態分化開始に関与する信号伝達経路を解明することを目的としている。 (1)amf(aerial mycelium formation)遺伝子群の解析 S.griseusのA-ファクター欠損株にプラスミド上で導入することでこの菌の気中菌糸形成を回復させる遺伝子の1つは、2つの互いに相同な膜透過に関与する一連の膜蛋白質群に属する蛋白(AmfA,AmfB)と、二成分制御系の応答因子に相同な制御蛋白(AmfR)の計3つの蛋白をコードしていた(Fig.1)。amfRの上流には同一の転写単位を成すと考えられる2つの読み取り枠ORF4及び5が存在しているが、その遺伝子産物はデータベースのどの蛋白とも相同性を示さなかった。AmfR蛋白のリン酸化残基と推定される54AspのAsnへの置換変異はこの遺伝子による気菌糸形成回復の活性を消失させることから、AmfRは他の応答蛋白同様、そのリン酸化、脱リン酸化を介して気菌糸形成開始の制御を司っていると予想される。サザン解析の結果、amfR,A,Bに対する相同遺伝子は他の放線菌には検出されなかったが、最近類似の活性を持つ遺伝子としてS.coelicolorA3(2)よりクローン化されたram遺伝子群は、塩基配列上の相同性は低いものの、amf遺伝子群と全く同様の蛋白をコードしていることが報告された。このことから、amf遺伝子群と同様の機能を担う遺伝子は他の放線菌一般に分布し、形態分化の制御に関わっていることが示唆される。  Fig.1 Fig.1 次にamfRを含む転写単位のプロモーター領域をORF5の上流に同定し、耐熱性リンゴ酸脱水素酵素をレポーターとする系を用いてその活性について検討した。その結果、このプロモーターはA-ファクターの非存在下で活性が高く、存在下で低いことが判明した。続いてプロモーター領域の切り縮めを行い、そのA-ファクターによる調節領域を転写開始点から-72bp〜-44bpの間に同定した。次にこの領域を含む62bpのDNA断片をプローブに用いたゲルシフトアッセイにより、この領域に特異的に結合する、A-ファクター非存在下にのみ検出される蛋白質の同定に成功した。この蛋白は栄養増殖期に発現していてamfR及び上流の2つの遺伝子の転写を活性化しており、菌自身によるA-ファクターの生産が起こると、AmfR蛋白のリン酸化等を介して細胞は気菌糸形成期に入り、その後何らかの機構によってこの蛋白の発現が抑えられ、それによりamfRの転写も抑えられるものと推測される。形態形成開始の分子機構を解明する上でこの蛋白の解析は重要であると判断し、続いてその精製を行った。A-ファクター欠損株S.griseusHH1の15L培養から、硫安分画、DEAE、MonoQ、Heparinクロマト、非変性PAGEからの溶出を経て、最終的にゲルシフトによる結合活性を有する蛋白はSDS-PAGE上で2本のバンドを与えた。これらの蛋白のN末端配列は、解析した15アミノ酸全てにわたって同一の配列を示しており、従って精製された蛋白は1種類であると判断された。今後この配列を基に遺伝子を取得、解析することで形態形成開始機構に関するさらなる知見が得られるものと考える。 (2)S.griseusのafsK遺伝子の取得とその形態形成における役割の解析 AfsK蛋白はS.coelicolorA3(2)の二次代謝をグローバルに制御する蛋白AfsRに対するキナーゼであり、それは真核生物型のSer-Thrキナーゼであった。このS.coelicolor A3(2)由来のafsK遺伝子を含むプラスミドをS.griseusのA-ファクター欠損株に導入するとその胞子形成の回復が観察されること、またK-252aをはじめとする真核型キナーゼ阻害剤がS.griseus野生株の形態形成を顕著に阻害することから、この菌の形態形成制御に真核型キナーゼAfsKが関与していることが予想され、この菌からのafsK遺伝子の取得ならびにその解析を行った。 取得したS.griseusのafsK相同遺伝子産物はS.coelicolorA3(2)と比較してアミノ酸配列上で約75%と非常に高い相同性を有する蛋白をコードしていた(Fig.2)。また上流に隣接して同一の方向に存在する読取り枠についても40%の相同性が認められ、AfsK蛋白の機能と何らかの関連を持つ蛋白であることが予想される。AfsK蛋白のこの菌における役割を調べるために、afsK遺伝子の一部とカナマイシン耐性遺伝子をクローニングしたE.coliのM13ファージ由来の一本鎖DNAを用いて、一回組換えによるafsK遺伝子破壊株を作成した。これまで制限系等の問題で困難とされていたS.griseusの遺伝子破壊に対し一本鎖DNAの利用は有効であった。取得したafsK破壊株は野生株と同様の生育を行うが、胞子形成の効率が低下していた。特にショ糖やソルビトールに由来する高浸透圧下における胞子形成が顕著に低下していた。  Fig.2 Fig.2 次に、E.coliを宿主に用いてT7プロモーターの下流に導入することでAfsK蛋白の大量発現を行い、尿素による可溶化後、DEAEクロマトにより精製AfsK蛋白を得た。これを用いたin vitroリン酸化実験により、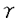 -ATPの存在下でAfsK蛋白の自己リン酸化を確認した。今後はAfsK蛋白のターゲットであるAfsR蛋白に対する相同遺伝子の取得・解析などを通じてAfsKによる制御機構がさらに明らかになるものと考える。 -ATPの存在下でAfsK蛋白の自己リン酸化を確認した。今後はAfsK蛋白のターゲットであるAfsR蛋白に対する相同遺伝子の取得・解析などを通じてAfsKによる制御機構がさらに明らかになるものと考える。 (3)高浸透圧下での形態形成開始を制御する遺伝子のクローニング 一般に、放線菌の形態分化誘導の外界要因としては栄養分の枯渇、乾燥、温度の他に浸透圧の関与が経験的に知られている。先のS.griseus afsK破壊株の形態形成能は高浸透圧条件下で顕著に低下していた。この他に外界の浸透圧を感知して形態形成の制御を司る遺伝子の存在が予備実験により示唆され、その同定を行った。 A-ファクター合成遺伝子afsA欠失変異株であるS.griseusHH1は、高浸透圧条件の栄養培地上ではA-ファクターを添加してもその形態形成の回復が起こらない。このことから、A-ファクターによる一連の信号伝達系の下流において高浸透圧下で形態形成を誘導するために必須の役割を担う制御遺伝子が、afsA周辺の欠失領域に存在することが予想された。実際にafsAの上流約3kbの領域に、それをプラスミド上で導入することで高浸透圧、A-ファクター添加の条件下でHH1株に形態形成を回復させる遺伝子(ORF1,2)を同定した。ORF1,2産物には他の蛋白との顕著な相同性はみられなかった。今後これらの遺伝子産物の機能に関する解析により、高浸透圧条件下における形態形成に関する全く新しい知見が得られるものと考える。 以上の成果により、放線菌S.griseusの形態分化に原核生物型のシグナル伝達系を構成するAmfR蛋白と、真核生物型の伝達系を構成するAfsK蛋白の両者が関与することが判明した。また真核型キナーゼ阻害剤K-252aは、afsK遺伝子による形態形成の回復は阻害する一方、amfRによるそれは全く阻害しないことから、この真核型と原核型の制御機構はそれぞれ全く独立に形態形成の開始を制御していることが示唆される。このように、A-ファクターをはじめとするシグナル物質の下流において、放線菌の形態形成開始機構には複数の性質の異なる信号伝達経路が関与していることが予想されるが、いずれにおいても蛋白質のリン酸化を介する制御機構が非常に重要な役割を果たしていることは明らかであるといえる。 |
| 審査要旨 | | 本論文は,放線菌Streptomyces griseusの形態分化に関わる遺伝子をクローン化しその構造を解析し,機能について述べている。本研究は,この菌で微生物ホルモン的に機能するA-ファクターの調節ネットワークに基づいたものである。 1.気中菌糸形成に関与するamf遺伝子群 S.griseusはストレプトマイシン等の二次代謝産物を生産すると共に,気中菌糸・胞子への分化を行う。S.griseusのA-ファクター欠損株(HH1株)はその為に栄養菌糸から気中菌糸の形態分化を開始できないことに基づき,この株にプラスミド上でそれ単独で形態分化を回復させる遺伝子を取得・解析した。HH1株にプラスミド上で導入することでこの菌の形態成を回復させる遺伝子の1つは,2つの互いに相同な膜透過に関与する一連の膜蛋白質群に属する蛋白(AmfA,AmfB)と,2成分制御系の応答因子に相同な制御蛋白(AmfR)の計3つの蛋白をコードしていた。amfRの上流には同一の転写単位を成すると考えられる2つの読み取り枠ORF4及び5が存在するが,その遺伝子産物は他の蛋白と相同性を示さなかった。AmfR蛋白のリン酸化残基と推定される54AspのAsnへの変異はこの遺伝子による気菌糸形成回復の回復の活性を消失させ,AmfRはそのリン酸化・脱リン酸化を介して気菌糸形成開始制御を司っていると予想される。類似の活性を持つS.coelicolorのram遺伝子群はamf遺伝子群と相同な蛋白をコードしており, amf相同遺伝子群は放線菌一般に分布し形態分化制御を行っていると予想される。amfRオペロンのプロモーター領域はORF5の上流に同定され,その活性はA-ファクターの非存在下で活性が高く存在下で低かった。プロモーター領域の切り縮めによりA-ファクター依存領域を-72bp〜-44bpに同定した。この領域を含むDNA断片をプローブに用いたゲルシフトアッセイにより,この領域に特異的に結合するA-ファクター非存在下にのみ検出される蛋白を同定した。次にHH1株の18L培養から,硫安分画,DEAE,MonoQ,Heparinクロマト,非変性PAGEからの溶出を経てこの蛋白を精製した。最終的にゲルシフトによる結合活性を有する蛋白はSDS-PAGE上で2本のバンドを与えたが,N末端配列が同一であることから精製蛋白は1種類と判断された。 2.形態分化に関与するセリン/スレオニンキナーゼ遺伝子 AfsK蛋白はS.coelicolorの二次代謝をグローバルに制御する蛋白AfsRに対するキナーゼであり,真核生物型のSer-Thrキナーゼである。このS.coelicolor由来のafsK遺伝子を含むプラスミドをHH1株に導入するとその胞子形成の回復が観察されること等から,この菌の形態形成制御にAfsKが関与していることが予想され,その解析を行った。S.griseusのAfsK蛋白はS.coelicolorと比較して約75%と非常に高い相同性を有しており,上流の読取り枠についても40%の相同性が認められた。相同組換えにより作成したS.griseusのafsK破壊株は高浸透下における胞子形成が顕著に低下していた。またE.coliのT7発現系を用いてAfsK蛋白の大量発現を行い尿素による可溶化後,DEAEクロマトにより精製し,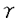 -ATPの存在下でその自己リン酸化を確認した。 -ATPの存在下でその自己リン酸化を確認した。 3.高浸透圧に応答して気菌糸形成開始を制御する遺伝子 最後にafsKの他に外界の浸透圧を感知して形態形成の制御を司る遺伝子の同定を行った。HH1株は高浸透圧条件下ではA-ファクターを添加しても形態形成の回復が起こらないことから,A-ファクターの下流で高浸透圧下の形態形成に必須の制御遺伝子がafsA周辺の欠失領域に存在することが予想された。実際にafsAの上流に高浸透圧,A-ファクター添加の条件下でHH1株に形態形成を回復させる遺伝子(ORF1,2)を同定した。ORF1,2産物には他の蛋白との顕著な相同性はみられなかった。 以上の結果,S.griseusの形態分化に原核型と真核型の信号伝達系が関与することが判明した。K-252aは,afsK遺伝子による形態形成回復は阻害する一方,amfRによるそれは全く阻害しないため,これらの制御機構は独立に存在することが示唆される。放線菌の形態形成開始機構にはA-ファクター等のシグナル物質の下流で複数の性質の異なる信号伝達経路が関与するが,いずれにおいても蛋白質のリン酸化が重要な役割を果たしている。 以上,本論文は放線菌の形態形成に関与するいくつかの遺伝子について述べてあり,学術上貢献するところが少なくない。よって審査員一同は,本論文が博士(農学)の学位論文として価値のあるものと認めた次第である。 |