| 内容要旨 | | アロステリック酵素は生体の代謝調節機構の根本を担うタンパク質であり、代謝経路のスイッチとして重要な働きをしている。本研究では嫌気性細菌Bifidobacterium longumのL-乳酸脱水素酵素(LDH)を材料に用いた。LDHはNAD+/NADHを補酵素とし乳酸/ピルビン酸の間の酸化還元反応を触媒する。LDHには脊椎動物由来の非アロステリック型酵素と、フルクトース1、6二リン酸(FBP)で活性化される細菌由来のアロステリック型酵素が存在する。嫌気性細菌B.longumのLDHも基質によるホモトロピックな活性化とFBPによるヘテロトロピックな活性化を受ける典型的なアロステリック酵素である。 本酵素はX線結晶構造解析により2つの状態の構造が明らかにされている。これらの構造は、四量体の対称性を保ったまま四次構造が大きく変化している。これはMonod-Wyman-Changeux型の協奏的アロステリック機構(MWCモデル)の考えと良く一致しており、それぞれが基質ピルビン酸に対する高親和性型(R状態)および低親和性型(T状態)の構造と考えられる。そして、本酵素の基質親和性の変化は、四次構造の変化に伴う活性部位の構造変化に起因することが解明されている。FBP結合部位は2つのサブユニットから構成され、FBPによる活性化はサブユニット間の相互作用の変化の結果と考えられる。本研究ではFBP結合部位を構成するアミノ酸残基を置換した変異型酵素を用い、NADHの蛍光測定によりLDHのアロステリック特性を解析するとともに、それら変異型酵素のX線結晶構造解析を行い、アロステリック転移における分子機構の詳細な解析を行った。 第一部NADHの蛍光測定によるL-乳酸脱水素酵素のアロステリック転移機構の解析 LDHの速度論的解析は、ピルビン酸の還元反応の測定によって行なわれてきた。しかしLDHは高濃度の基質により活性が阻害され、しかも基質阻害の機構は分かっていない。このためアロステリック特性の精密な解析は困難であった。そこでNADHの蛍光が酵素との結合及びその複合体への基質類似体であるオキザム酸の結合により変化することを利用し、本酵素のアロステリック転移を解析した。解析には野生型酵素の他に、FBP結合部位を構成するArg173,His188に関する変異型酵素、R173Q、H188Y、R173Q/H188Y(Arg173、His188両方を置換した変異体)を用いた。 野生型酵素へのNADHの結合は双曲線型であるが、FBPの添加によってシグモイド型の飽和曲線を示すようになり、FBPはNADHの結合に対してヘテロトロピックな阻害を示すことが明らかになった。これに対し本酵素のオキザム酸との結合はピルビン酸と同様、FBPによりヘテロトロピックに活性化された。 変異型酵素R173QはFBPによって野生型酵素同様、NADH結合の阻害及びオキザム酸結合の活性化を受けるが、FBPに対する感受性は野生型酵素より1000倍も低くなっていた。これに対しHis188の変異型酵素、H188Y、R173Q/H188Yでは、NADHならびにオキザム酸の結合はFBPによって影響を受けなかった。これらの結果から、NADHの酵素に対する親和性は、FBPにより安定化されたR状態の酵素に比べて、T状態の酵素に対しより高いことが分かった。 野生型酵素で既に解かれた2つの構造のNADH結合部位を比較すると、T状態の構造ではNADHのニコチンアミド環が疎水性残基であるIle239,Ile240と相互作用できるのに対し、R状態の構造ではオキザム酸の活性部位への結合及びActive site loopの構造変化によって環境が大きく変化しており、親和性の変化が示唆される。 本酵素のアロステリック機構をMWCモデルを用いて解析した。本酵素はアポ酵素ではR状態とT状態の比は2:1程度と考えられるが、NADHの結合によりT状態が安定化されその比は1.5mM NADH中でR:T=1:4000程度までになる。逆にFBPは、T状態の酵素と比較してR状態の酵素に対し親和性が約10倍大きいため、R状態を安定化し酵素を活性化する。しかしその効果は、500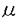 MFBP存在下においてもR:T=1:25程度であり、まだなおT状態が優勢である。このようにNADHの親和性の差異が、本酵素のアロステリック特性に大きな役割を果たしていることが解明された。 MFBP存在下においてもR:T=1:25程度であり、まだなおT状態が優勢である。このようにNADHの親和性の差異が、本酵素のアロステリック特性に大きな役割を果たしていることが解明された。 第二部変異型酵素のX線結晶構造解析 本酵素のアロステリック特性をさらに詳細に検討するため、変異型酵素の結晶構造解析を行った。 第一章変異型酵素の結晶化 各変異型酵素R173Q、H188Y、R173Q/H188Yより、野生型酵素で既に解かれたT状態の結晶(P21212、a=105.8Å,b=131.4Å,c=63.8Å)と同型の結晶(タイプ1)が得られた。またR状態を優勢にする条件で結晶化を行うことで、R173Q、R173Q/H188Yからはいままで野生型酵素で解かれた結晶と空間群の異なる結晶(タイプ2)が得られた。この結晶は単斜晶系に属する結晶で、空間群はC2と決定された。格子定数はa=160.6Å,b=77.7Å,c=123.6Å,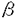 =94.4゜であり、非対称単位に一つの四量体を含むと推定された。 =94.4゜であり、非対称単位に一つの四量体を含むと推定された。 第二章シンクロトロン放射光及び巨大分子用ワイセンベルグカメラを用いるシステムによる回折強度データの収集 高エネルギー物理学研究所放射光実験施設のBL6A2ハッチに設置された巨大分子用ワイセンベルグカメラを用いるシステムにより変異型酵素の結晶からの回折強度データを収集した。各変異型酵素のタイプ1の結晶からは2.2〜2.5Å程度の分解能のデータが得られた。またタイプ2の結晶からは2.5Å程度の分解能のデータが得られた。 第三章タイプ2の結晶型をもつ変異型酵素R173Q/H188Y及びR173Qの分子置換法による構造決定 解析用プログラムX-PLORを用いて、R173Q/H188Yのタイプ2結晶の構造決定を分子置換法により行った。モデル分子としてT状態、及びR状態の野生型酵素の座標をもとにして回転関数と並進関数を計算した。その結果、R状態の野生型酵素の四量体をモデルとしたときのみ、回転(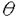 1, 1,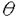 2, 2,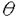 3)=(74.5゜,47.5゜,295.4°)、並進(x,z)=(0.150,0.250)の単一の解を見い出した。この解を初期モデルとしX-PLORを用いて精密化を行った結果、分解能6〜2.5Åの45,824(理論的に収集可能な反射の86.8%)反射に対し、R因子19.9%にまで構造を精密化できた。この構造は非対称単位にR状態の酵素の四量体を含み、各サブユニットに1分子づつNADH、及びオキザム酸が結合していた。 3)=(74.5゜,47.5゜,295.4°)、並進(x,z)=(0.150,0.250)の単一の解を見い出した。この解を初期モデルとしX-PLORを用いて精密化を行った結果、分解能6〜2.5Åの45,824(理論的に収集可能な反射の86.8%)反射に対し、R因子19.9%にまで構造を精密化できた。この構造は非対称単位にR状態の酵素の四量体を含み、各サブユニットに1分子づつNADH、及びオキザム酸が結合していた。 また、この構造を初期モデルとしてR173Qのタイプ2結晶の構造決定を行った。R173Qのタイプ2結晶の非対称単位には上記の分子のほかに2分子のFBPが含まれていた。 これらの構造は異なる空間群の結晶で解かれた野生型酵素のR状態の構造とほぼ一致しており、野生型酵素とR173Q/H188YのC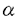 原子位置を最小二乗法で重ね合わせたときのrmsdeviationは0.61Åであった。 原子位置を最小二乗法で重ね合わせたときのrmsdeviationは0.61Åであった。 変異型酵素R173Q/H188YはFBPを結合することができず、その構造はオキザム酸によりホモトロピックに活性化された構造である。FBPにより活性化された野生型酵素のR状態と比較して構造に大きな差はなく、FBP非存在下でも同様の活性部位が形成されていることが確認された。また各サブユニットは結晶学的に独立であるが、これらのサブユニットは同一の構造をしており、222の対称性を保持していた。これらの知見は本酵素のアロステリック機構がMWCモデルの仮定と良く一致していることを示している。 第四章タイプ1の結晶型をもつ変異型酵素R173Q、H188Y、R173Q/H188Yの構造決定 タイプ1の結晶型をもつ変異型酵素R173Q、H188Y、R173Q/H188YのT状態の構造決定を行った。初期モデルは、同型の野生型酵素の構造を用いた差フーリエ合成図、及び2|fo|-|fc|合成図により作製した。X-PLORを用いて座標の精密化を行い、それぞれ構造をR因子20%程度にまで精密化した。タイプ1結晶の非対称単位にはT状態の酵素の二量体を含み、各サブユニットに1分子づつNADHが結合していた。FBP存在下で結晶化した結晶では、変異型酵素R173QにのみFBPの結合が見られた。これらの構造は野生型酵素のT状態と比較して三次構造及び四次構造に大きな変化は認められなかった。 これらの構造から本酵素のFBPによる活性化機構を考察した。FBPによって活性化を受ける変異型酵素R173QにおいてGln173残基のFBPとの相互作用は認められず、173番残基とFBPの相互作用は活性化に必須ではないことが分かった。FBPはHis188に結合することによって、T→R転移における188番残基を含む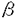 G鎖同士の接近を安定化する。これによってR状態に平衡をずらし活性化すると考えられる。 G鎖同士の接近を安定化する。これによってR状態に平衡をずらし活性化すると考えられる。 第三部総合討論 第一部と第二部の知見から本酵素のアロステリック転移機構について考察した。本酵素のTR転移は、大きな三次構造変化を伴わない四次構造変化である。NADH及びFBPの結合部位はそれぞれq軸、p軸を介したサブユニットの結合部位に存在し、結合によりサブユニット間の相互作用を変化させることによりアロステリック特性を調節していること示された。 |
| 審査要旨 | | 本論文は,嫌気性細菌Bifidobacterium longumのL-乳酸脱水素酵素(LDH)を材料に用いたアロステリック転移機構の解析に関する研究である。本酵素は基質によるホモトロピックな活性化とフルクトース1,6二リン酸(FBP)によるヘテロトロピックな活性化を受ける典型的なアロステリック酵素である。本酵素はX線結晶構造解析により,基質ピルビン酸に対する高親和性型(R状態)及び低親和性型(T状態)と考えられる2つの状態の構造が明らかにされている。これらの構造は,四量体の対称性を保ったまま四次構造が大きく変化しており,協奏的アロステリック機構(MWCモデル)の考えと良く一致している。本研究ではFBP結合部位を構成するArg173,His188に関する変異型酵素,R173Q,H188Y,R173Q/H188Y(Arg173,His188両方を置換した変異体)を用い,NADHの蛍光測定によりLDHのアロステリック特性を解析し,さらにそれら変異型酵素のX線結晶構造解析を行い,アロステリック転移における分子機構の詳細な解析を試みたものである。 第一部はNADHの蛍光測定によるL-乳酸脱水素酵素のアロステリック転移機構の解析について述べたものである。野生型酵素及び変異型酵素の解析により,本酵素とNADHの結合はFBPによってヘテロトロピックに阻害されることが明らかになった。これに対し基質類似体のオキザム酸と本酵素の結合はピルビン酸と同様,FBPによりヘテロトロピックに活性化された。本酵素はFBPという一つのアロステリックエフェクターによって阻害作用と活性化作用の両方を受ける興味深い性質を持つことが分かった。これらの結果からNADHの本酵素に対する親和性は,ピルビン酸及びオキザム酸とは逆にFBPにより安定化されたR状態よりT状態の酵素に対しより高いことを明らかにした。 本酵素のアロステリック機構をMWCモデルを用いて解析した。本酵素はアポ酵素ではR状態:T状態の比は2:1程度と考えられるが,NADHの結合によりT状態が安定化されその比は1.5mM NADH中でR:T=1:4700程度までになる。逆にFBPは,T状態の酵素と比較してR状態の酵素に対し親和性が約10倍大きいため,R状態を安定化し酵素を活性化する。しかしその効果は,500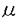 M FBP存在下においてもR:T=1:24程度であり,まだなおT状態が優勢である。このように両状態に対するNADHの親和性の差が,本酵素のアロステリック特性に大きな役割を果たしていることを解明した。 M FBP存在下においてもR:T=1:24程度であり,まだなおT状態が優勢である。このように両状態に対するNADHの親和性の差が,本酵素のアロステリック特性に大きな役割を果たしていることを解明した。 第二部は変異型酵素の結晶構造解析について述べたものである。本酵素のアロステリック特性をさらに詳細に検討するため,変異型酵素の結晶構造解析を行った。各変異型酵素よりT状態の結晶,タイプ1,が得られた。またR173Q,R173Q/H188Yからはいままで野生型酵素で解かれた結晶と空間群の異なる結晶,タイプ2,が得られた。 分子置換法によりタイプ2結晶の構造を解析し,変異体酵素のR状態の構造を決定した。R173Q/H188Yの構造は分解能2.3ÅでR因子20.2%にまで,R173Qの構造は分解能2.5ÅでR因子20.9%にまで構造を精密化できた。ホモトロピックに活性化された変異型酵素R173Q/H188YのR状態の構造とFBPによりヘテロトロピックに活性化された野生型酵素のR状態の構造を比較したところ,全体の構造に大きな違いはなく,活性部位も同様に形成されていることが確認された。また各サブユニットは対称性を保持しており,これらの点でも本酵素のアロステリック機構はMWCモデルと良く一致していた。 タイプ1結晶を用い,変異型酵素R173Q,H188Y,R173Q/H188YのT状態の構造決定を行った。各変異型酵素のT状態とR状態の構造の比較から本酵素のFBPによる活性化機構を考察した。その結果,173番残基とFBPの相互作用は活性化に必須ではないことが分かった。FBPはHis188に結合することによって,T→R転移における188番残基同士の接近を安定化する。これによってR状態に平衡を移動させることが,FBPによる活性化の分子機構であることを明らかにした。 以上本論文は,NADHの蛍光強度変化を利用した解析によって本酵素のアロステリック特性を精密に決定し,また変異型酵素の構造解析を行うことによって,FBPの活性化の分子機構をはっきりと確認することに成功したもので,酵素のアロステリック機構の解析という学術上,応用上重要な課題に,多大な貢献を与えたものである。よって審査員一同は,申請者に博士(農学)の学位を授与してしかるべきものと判定した。 |