| 審査要旨 | | 酵母Candida maltosa IAM12247株は二倍体ゲノムを有する酵母で,n-アルカンを唯一の炭素源として生育させると,チトクロームP450(P450)やチトクロームP450レダクターゼ(P450レダーゼ)などの酵素群の発現が誘導され,同時に小胞体,パーオキシソームなどの細胞内膜系の顕著な発達が観察される。n-アルカンのようなきわめて疎水性の高い物質によって引き起こされるこのような細胞内変化の分子機構にはたいへん興味深いものである。本研究では,C.maltosaにおける誘導的発現ベクター系を開発し,更にこの系を用いてチトクロームP450ALK(P450AKL)の大量発現を行い,それに伴って発達する小胞体の誘導にかかわる要因を生化学的,形態学的に解析し,本菌における小胞体の誘導生成機構に関する知見を得ることを目的とした。 第1章では細胞内で遺伝子を大量に発現させる際に最も重要となる,強力に発現するプロモーターの取得を目的とした。そこで,ガラクトース存在下で誘導性もつG.maltosaのGAL1とGAL10遺伝子を,Saccharomyces cerevisiasのGAL1をプローブとしてC.maltosaのゲノムライブラリーを検索し,クローン化した。その結果,得られたGAL1及びGAL10遺伝子とそれぞれ高い相同性を示した。また,両遺伝子がプロモーター領域を挾んで逆向きに位置しているというS.cerevisias及びK.lactisに見られる構造も保存されていた。ノーザン解析を行った結果,炭素源による誘導的発現を確かめた。 第2章では前章で得られたC.maltosaのGAL1とGAL10の両遺伝子のプロモーター領域を用い,セントロメア(CFN)と自律的複製配列(ARS)を持つYCp型のベクターpMGA2を,ARSだけをもつYCp型のベクターpNGH2をそれぞれ構築した。これらのベクターのGAL10プロセータ下流に異種遺伝子であるK.lactisの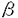 -ガラクトシダーゼ遺伝子,LAC4を,GAL1プロモーター下流には同種遺伝子,チトクロームP450ALK1(あるいはP450ALK3など)の大量発現を試みた。高コピーベクターpNGH2による生産量は低コピーベクターpMGA2による場合に比べていずれの場合も100倍程度高かった。 -ガラクトシダーゼ遺伝子,LAC4を,GAL1プロモーター下流には同種遺伝子,チトクロームP450ALK1(あるいはP450ALK3など)の大量発現を試みた。高コピーベクターpNGH2による生産量は低コピーベクターpMGA2による場合に比べていずれの場合も100倍程度高かった。 最近C.albicansなどの広範のCandida属酵母では,変則コドン(CUG=Ser)が使用されていることが報告された。我々が用いたC.maltosaでもtRNAserCAGが存在しており,同様な変則コドンを使用することをin vivoで証明した。従ってこれら生物の遺伝子の機能の解析にも本研究で作製し九ベクターは有用であると考えられる。 第3章では,複数存在するP450ALKの中でP450ALK1,P450ALK3の大量発現が小胞体膜の生合成に与える影響を調べた。このときのP450の生産はSDS-ポリアクリルアミドゲル電気泳動及びCO-還元差スペクトルで確認した。電子顕微鏡による細胞内構造の観察では核を取り巻くいわゆるkarmellae状の膜構造を含む顕著な小胞体の発達が見られ,そこに免疫標識によって誘導したP450の局在が認められた。P450誘導に伴い生体膜成分であるリン脂質の含量の上昇及びリン脂質合成系のホスファチジルセリンターゼの比活性の上昇がベクターのみの株に比べて観察された。これらの結果は,特定の小胞体膜蛋白質成合の合成によって小胞体膜の合成が誘導され,膜リン脂質合成系も活性化されていることを強く示唆するものである。さらにこのような小胞体膜の誘導は他の小胞体膜蛋白質の合成にも影響を与えることが考えられる。そこで,他のP450ALK遺伝子の転写に与える影響をNorthern解析とLAC4をレポーター遺伝子として用いたプロモーター活性解析で調べた。その結果,P450ALK3を誘導合成した場合にP450ALK5遺伝子の転写が活性化された。この結果は,P450ALK5遺伝子のプロモーターが小胞体膜合成の昂進に反応するものである可能性を示しているが,P450ALK3の酵素作用の結果生ずる酸化物によって二次的に誘導された可能性も否定できず,今後変異体型P450ALK3のような誘導の影響などを解析する必要があろう。このような現象はP450ALK1の誘導合成の場合は見られなかった。これらの結果は特定の小胞体膜蛋白質の合成に誘起されて他の小胞体膜成分の合成が促進していることを示唆するものであり,今後の小胞体膜生合成制御の解明に大きな手掛かりを得るものと考えられる。 以上本論文では,酵母C.maltosaにおける発現ベクター系の開発と,それを利用した小胞体形成機構の分析を詳細に行っており,学術上貢献するところが少くない。よって審査員一同は,申請者に博士(農学)の学位を授与してしかるべきものと判定した。 |