| 内容要旨 | | 微小管は全ての真核生物において最も主要な細胞骨格の構成要素の一つであり、特に神経系に豊富であることが知られている。微小管システムは細胞中で多様な運動(organelle transport,細胞分裂)や、細胞形態の維持に働いている。これらの機能は微小管と結合する微小管関連蛋白(microtubule-associated proteins:MAPs)によって仲介されていると考えられる。神経細胞では主に2つのタイプのMAPsの存在が明らかにされた。まず最初のクラスはforce-producing MAPsあるいはmotor proteinと呼ばれる一群であり、主なものにキネシンや細胞質ダイニンがある。 キネシンは二つの重鎖(120-124kDa)と二つの軽鎖(62-64kDa)からなる。重鎖はATPと微小管への結合部位を持つ。形態学的観察から,キネシンは微小管に重鎖の球状部分で結合し,オルガネラには反対側の軽鎖のある扇状の部分で結合していることが示唆された。キネシンはin vitroで微小管をプラス方向へ動かす力を生じることから順行性の輸送のモーターであるとみなされる。神経細胞ではキネシンは順行性の軸索輸送に働いていると考えられる。カバースリップ上でキネシンが微小管を動かすスピードは0.3-0.6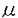 m/sである。 m/sである。 細胞質ダイニンはATPの加水分解部位を含むと考えられる二つの重鎖と,74kDaの三つのサブユニットと,59,57,55及び53kDaのサブユニットからなる。細胞質ダイニンの役割は,in vitroで微小管をマイナス方向へ動かす力を生じることから逆行性の輸送のモーターであるとみなされる。神軽細胞では細胞質ダイニンは逆行性の軸索輸送に働いていると考えられる。カバースリップ上で細胞質ダイニンが微小管を動かすスピードは1-2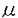 m/sである。 m/sである。 もう一つのクラスがfibrous MAPsであり、主なものにタウやMAP2があり,さらにMAP2c,MAP1A,1Bを含む。これらの蛋白は微小管の重合や安定性を促進し、神経突起の形成や維持に働く。 二つのクラスそれぞれの構造や機能については多くの研究がなされているにもかかわらず、force-producing MAPsとfibrous MAPsがお互いに微小管上でどのような相互作用をおこすのかという研究は極めて少ない。もしこれらが微小管との結合において競合するとすると、これは微小管上でのmotor分子によるトランスポートをfibrous MAPsが制御するという可能性を示す興味ある重要な問題である。この,force-producing MAPsとfibrous MAPsとの相互作用をより明確に,詳細に研究するために,我々はラットの脳から精製してきたキネシン及び細胞質ダイニンとタウ及びMAP2を用意した。そして次の二つの問題点を設定した。 I.キネシン,細胞質ダイニンとタウ,MAP2は微小管との結合において競合するのか。もし競合があるのならば,それは微小管上の共通の結合部位で結合を競合するからなのか,それともfibrous MAPsのプロジェクションによる物理的な障害によるものなのか,あるいはその両方なのか。 II.キネシン,細胞質ダイニン,タウ,MAP2の微小管との結合部位は微小管上のどの領域にあるのか。 これらの問題点を解明するために,我々は以下の三つの実験系を用いた。 A.Competition Experiment 微小管とキネシンもしくは細胞質ダイニンを飽和量結合させておき,それにタウを加える。もし両者が競合するとすると,タウがキネシンもしくは細胞質ダイニンを追い出して微小管と結合するはずである。その結果,微小管と結合していたキネシンあるいは細胞質ダイニンはPelletにおける結合量は減少し,そのはじかれた分がSupernetantに出てくると考えられる。一方競合しないとすると,タウを加えてもキネシンもしくは細胞質ダイニンと微小管との結合には影響はないはずである。したがってその結合量は一定であると考えられる。 B.Motility Assay 我々は完全に精製したキネシンもしくは細胞質ダイニンによる微小管のglidingを,AVECシステム(微分干渉顕微鏡-ビデオカメラ-画像処理システム)の下で観察することを可能にした。まず,タウあるいはMAP2というMAPs成分を加えない状態で,ほぼ100%微小管のglidingがおこることを確認し,これをcontrolとした。これにタウもしくはMAP2を加えて微小管のglidingに抑制がかかるかどうかを観察することによって,競合の有無を調べた。 C.Cosedimentation Experiment 微小管はサブチリシンによってそのC末端が分解されるということはよく知られている。そのサブチリシンとの反応時間によって微小管の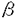 サブユニットだけが切れたものと ( サブユニットだけが切れたものと (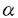 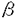 s)と s)と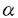 , ,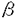 両方とも切れたもの( 両方とも切れたもの(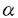 s s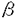 s)が得られる(Melkiら)。これらとキネシン,細胞質ダイニン,タウ,MAP2の結合結果からそれぞれの微小管上の結合領域を特定した。すなわち,これらのmoleculeの結合の挙動が同じであるかどうかをまずみた。さらにその結合量からそれぞれの微小管結合領域が,サブチリシン切断部位を目印にしたときに, s)が得られる(Melkiら)。これらとキネシン,細胞質ダイニン,タウ,MAP2の結合結果からそれぞれの微小管上の結合領域を特定した。すなわち,これらのmoleculeの結合の挙動が同じであるかどうかをまずみた。さらにその結合量からそれぞれの微小管結合領域が,サブチリシン切断部位を目印にしたときに,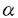 サブユニット, サブユニット,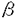 -サブユニットそれぞれでN末側,C末側どちら側にあるかという相対的位置関係を考察した。 -サブユニットそれぞれでN末側,C末側どちら側にあるかという相対的位置関係を考察した。 これらの実験は,タウ,MAP2のプロジェクション部分による物理的な障害と,結合部位における競合とを区別するために,精製したネイティブなタウ,MAP2(Taupw,MAP2pw)とともに,タウ,MAP2の微小管結合部位のみを大腸菌に発現させた蛋白(TauBS,MAP2BS)も調製し,同様に解析した。 その結果は以下のようになった。 まず,A.Competition Experimentにおいて,我々はまず微小管にキネシンもしくは細胞質ダイニンを飽和量結合させた。それにタウのネイティブなもの(Taupw)もしくはタウの微小管結合部位のみのもの(TauBS)を加えてその影響をみた。結果はキネシンでも細胞質ダイニンでも,タウを加えることによってはじき出されてsupernatantに出できており,一方微小管との結合量は減少してきていることが電気泳動ゲル上から明らかになった。さらにこれをdensitometerでスキャンして微小管との結合量の比率を求めたところ,これは加えたタウの量依存的な反応で特異的なものであることが分かった。またこの影響はTaupwでもTauBSでも同じであった。従ってキネシンもしくは細胞質ダイニンとタウは微小管との結合において競合していることが明らかになった。ただしこの実験ではTaupwとTauBSの影響の差すなわちプロジェクションの部分の影響の差については明らかにはできなかった。 次に,B.Motility Assayにおいて我々はまずカバースリップ上にキネシンもしくは細胞質ダイニンを吸着させてそれに微小管を加えてAVECシステムの下でほぼ100%微小管のglidingが起きることを確認した。この反応液にTaupw,TauBS,あるいはMAP2BSを加えたとき,微小管の動きに抑制がかかるかを観察した。この加え方を3通り行ったが,まずプロシージャーaでは微小管,MAPsをそれぞれ同時に加えた。プロシージャーbでは微小管とMAPsをあらかじめ一緒にインキュベートしておき,それを加えた。プロシージャーcではbの反応液を更に遠心してそのペレットをサスペンドして加えた。AVECのモニター上での観察およびassayの結果からプロシージャーaではMAPsはあまり微小管とは結合せず,カバースリップの表面に吸着されてまったようである。プロシージャーbではMAPsは微小管によく結合しており,プロシージャーcでは微小管はバンドルを形成していた。加えるMAPsの量を増やしてassayを行った結果をまとめると,キネシンでも細胞質ダイニンでもMAPsを加えることによって微小管の動きが抑制されることが明らかになった。これはTaupwでもTauBSでもMAP2BSでも同様の結果であった。またTaupwとTauBSの影響の差は,キネシンでも細胞質ダイニンでもTaupwの方がTauBSよりも抑制の度合いが大きいといことが分かった。 最後にC.Cosedimentation Experimentの結果であるが,キネシン,細胞質ダニン,タウ,MAP2いずれも,微小管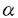 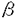 , ,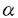 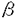 s, s,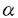 s s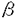 sの結合に際して同じような挙動をとるということが明らかになった。すなわちいずれのmoleculeでも sの結合に際して同じような挙動をとるということが明らかになった。すなわちいずれのmoleculeでも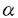 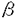 及び 及び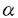 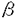 sとの結合量はほぼ同じであるのに対して, sとの結合量はほぼ同じであるのに対して,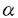 s s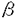 sにおいてはいずれも結合量が若干減少していることが電気泳動ゲル上から示された。これによってキネシンや細胞質ダイニンと,タウMAP2は共通の領域で微小管と結合するということが示唆された。このことはキネシンもしくは細胞質ダイニンと微小管 sにおいてはいずれも結合量が若干減少していることが電気泳動ゲル上から示された。これによってキネシンや細胞質ダイニンと,タウMAP2は共通の領域で微小管と結合するということが示唆された。このことはキネシンもしくは細胞質ダイニンと微小管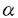 s s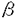 sとのmotility assayの結果でも確認された。さらに結合量をdensitometerでスキャンした結果,キネシン,細胞質ダイニン,タウ,MAP2それぞれの sとのmotility assayの結果でも確認された。さらに結合量をdensitometerでスキャンした結果,キネシン,細胞質ダイニン,タウ,MAP2それぞれの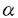 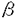 : :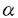 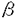 s: s: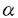 s s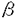 sとの結合の比率は1:(0.8-1.0):(0.6-0.7)であることが明らかになった。この結果からそれぞれの微小管上の結合部位はサブチリシンで切断される部位を目印にした相対的位置関係は, sとの結合の比率は1:(0.8-1.0):(0.6-0.7)であることが明らかになった。この結果からそれぞれの微小管上の結合部位はサブチリシンで切断される部位を目印にした相対的位置関係は,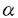 サブユニットではサブチリシン切断部位のC末側,一方 サブユニットではサブチリシン切断部位のC末側,一方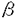 サブユニットではサブチリシン切断部位のN末側であると考えると最も埋解しやすい。 サブユニットではサブチリシン切断部位のN末側であると考えると最も埋解しやすい。 以上三つの実験の結果は矛盾無く一貫しており以下のようにまとめることができる。すなわち,force-poducing MAPsあるいはmotor proteinであるキネシンや細胞質ダイニンは,fibrous MAPsであるタウ,MAP2と微小管上共通の領域で微小管との結合を競合している。さらに微小管結合部分での競合に加えて,タウ及びMAP2のプロジェクション部分が,キネシンや細胞質ダイニンが微小管に結合する際に物理的な障害となって働いている。 この結果は,キネシンや細胞質ダイニンによる軸索輸送は,タウやMAP2と微小管への結合を競合することによって制御を受けるという可能性をを示唆している。 |
| 審査要旨 | | 本研究は微小管関連蛋白(microtubule-associated proteins:MAPs)の2つの主要なクラスであるforce-producing MAPs(主なものにキネシンや細胞質ダイニン)とfibrous MAPs(主なものにタウやMAP2)が、微小管との結合においてお互いにどのような相互作用をおこすのかを明らかにするためになされた。そのために、A.Competition Experiment,B.Motility Assay,C.Cosedimentation Experimentという3つの系を用いて、 I.キネシン,細胞質ダイニンとタウ,MAP2は微小管との結合において競合するのか。もし競合があるのならば,それは微小管上の共通の結合部位で結合を競合するからなのか,それともfibrous MAPsのプロジェクションによる物理的な障害によるものなのか,あるいはその両方なのか。 II.キネシン,細胞質ダイニン,タウ,MAP2の微小管との結合部位は微小管上のどの領域にあるのか。 という問題について解析が試みられ、下記の結果を得ている。 1.Competition Experimentを行ったところ、キネシンもしくは細胞質ダイニンとタウは微小管との結合において競合している事が示された。ただしこの系ではプロジェクションの部分の影響の差については明らかには示されなかった。 2.AVECシステムを用いMotility Assayを行ったところ、キネシンでも細胞質ダイニンでもMAPsを加えることによって微小管の動きが抑制される事が示された。またタウでもMAP2でも、キネシンあるいは細胞質ダイニンと微小管との結合において競合することに加えて、それぞれのプロジェクションの部分が物理的な障害として作用している事が示された。 3.Cosedimentation Experimentを行ったところ、キネシン,細胞質ダニン,タウ,MAP2いずれも,微小管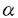 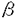 , ,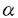 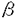 s, s,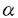 s s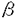 sの結合に際して同じような挙動をとるという事が示された。これによってキネシンや細胞質ダイニンと,タウMAP2は共通の領域で微小管と結合するということが示唆された。この結果からそれぞれの微小管上の結合部位はサブチリシンで切断される部位を目印にした相対的位置関係は, sの結合に際して同じような挙動をとるという事が示された。これによってキネシンや細胞質ダイニンと,タウMAP2は共通の領域で微小管と結合するということが示唆された。この結果からそれぞれの微小管上の結合部位はサブチリシンで切断される部位を目印にした相対的位置関係は,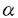 サブユニットではサブチリシン切断部位のC末側,一方 サブユニットではサブチリシン切断部位のC末側,一方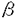 サブユニットではサブチリシン切断部位のN末側であると考えられた。 サブユニットではサブチリシン切断部位のN末側であると考えられた。 以上、本論文はforce-producing MAPsであるキネシンや細胞質ダイニンは,fibrous MAPsであるタウ,MAP2と微小管上共通の領域で微小管との結合を競合しており、さらに微小管結合部分での競合に加えて,タウ及びMAP2のプロジェクション部分が,キネシンや細胞質ダイニンが微小管に結合する際に物理的な障害となって働いているということを明らかにした。本研究はこれまであまり明らかにされていなかった2つのクラスのMAPsの微小管との結合における相互作用の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |