高等動物の神経細胞では様々な細胞内成分(ミトコンドリア、シナプス小胞の前駆体、軸索の細胞質膜前駆体、デンスコアード小胞など)が異なる速度で軸索や樹状突起内の異なる方向に微小管に沿って輸送され、それらの目的とする場所に振り分けられるので、神経細胞において従来報告されている二つのモーター、つまり、キネシンと脳ダイニン以外にも数種類の新しいモーターが存在するだろうと考えられる。このような細胞内膜小器官輸送の機構を更に深く知ろうと、未知のモーター蛋白の同定が試みられた。 本研究はマウス脳から分子生物学的手法であるPCRによって同定された新しいモーター蛋白KIF4について、分子細胞生物学的な解析を行ったものであり、下記の結果を得ている。 1.5日齢マウスの脳cDNAライブラリーをKIF4のPCR断片をプローブとしてスクリーニングし、全一次構造を決定したところ、KIF4は1,231個のアミノ酸からなり、分子量が139,550であることが推定された。 2.KIF4とショウジョウバエのキネシンの一次構造を比較したところ、KIF4のN末端ドメイン(1-350アミノ酸酸基)はキネシンのN末端モータードメインと非常に高い類似性を持っており、KIF4はN末端にモータードメインを持つタイプであることがわかった。KIF4の他の領域はキネシンや他のキネシンスーパーファミリーと有為な相同性を示さなかったので、KIF4は新しいキネシンスーパーファミリーの一員であることがわかった。二次構造予測では、N末端モータードメイン(1-350アミノ酸酸基)は球状の構造をしていると考えられる。中央ドメイン(351-1,005酸基)は3個の大きな棒状の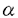 -ヘリックス構造(401-489、554-750、811-1,005酸基)を含んでおり、C末端ドメイン(1,006-1,231酸基)は球状をしていると考えられる。 -ヘリックス構造(401-489、554-750、811-1,005酸基)を含んでおり、C末端ドメイン(1,006-1,231酸基)は球状をしていると考えられる。 3.KIF4蛋白質の生化学的及び生理学的性質を調べる為に、バキュロウィルスSf9細胞系でKIF4蛋白質を大量発現し、蛋白を精製した。精製方法は、まず2mM AMP-PNP(非加水分解型ATPアナログ)存在下でKIF4蛋白質を微小管と共沈し、沈殿を10mM ATPと200mM KClを含んだバッファー中で懸濁し、微小管からはがれたKIF4蛋白質を遠心後上清に集めた。その上精をショ糖密度勾配遠心にかけ、KIF4蛋白質の画分を更に陰イオン交換クロマトグラフィーにかけた。KIF4のATPase活性は6.1nmol/mg/minであり、この活性は微小管によって35倍(2.1×102nmol/mg/min)に増強された。 4.KIF4で覆われたカバーグラスの上で微小管の運動性を調べたところ、微小管はキネシンの十分の一の速度(0.034±0.004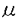 m/s,n=44)で動いた。次にChlamydomonasの鞭毛から精製した軸糸を使って運動の方向性を調べたところ、KIF4で覆われたカバーグラスの上で軸糸はコンパクト(マイナス)端に向かって動いた。この時の速度は0.20±0.02 m/s,n=44)で動いた。次にChlamydomonasの鞭毛から精製した軸糸を使って運動の方向性を調べたところ、KIF4で覆われたカバーグラスの上で軸糸はコンパクト(マイナス)端に向かって動いた。この時の速度は0.20±0.02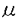 m/s(n=45)であった。従って、KIF4はプラス端方向のモーター蛋白であることが示唆された。 m/s(n=45)であった。従って、KIF4はプラス端方向のモーター蛋白であることが示唆された。 5.KIF4蛋白の分子微細構造を低角度回転蒸着法で調べた。KIF4分子は片側に2個の球状の頭部を持った長い棒状の構造をしており、全長は116±4nm(n=77)で、頭部の直径は12±0.6nm(n=53)であった。また、棒状部分の中には球状頭部の付け根から60±10nm(n=30)のところに屈曲する部分があった。 6.KIF4転写産物の大きさ、発生時期における発現及び組織分布を調べる為に、ノザンブロット解析を行った。マウスでは4.5kbpの単一の転写産物が検出された。転写産物は脳では生後5日まで発現し、その後徐々に減少し、大人の脳ではほとんど完全になくなっていた。転写産物は生後0日ではすべての組織で発現しているが、マウスが大きくなるに連れひ臓以外のすべての組織で減少し、大人ではひ臓のみで発現していた。 7.脳においてKIF4の詳しい発現パターンを調べる為に、in situハイブリダイゼーションを行った。生後5日の脳においてKIF4転写産物は海馬のCA1野、CA2野、CA3野及び歯状回と小脳皮質の外顆粒層及び内顆粒層に多く発現していた。高倍率で見ると、海馬の錘体細胞や小脳の顆粒細胞にシグナルが検出された。従って、KIF4は幼若な神経細胞に有為に発現されると考えられる。よって、KIF4は発生時期によりその発現が制御されている。 8.Sf9細胞で発現されたKIF4蛋白を抗原としウサギポリクローナル抗体を作製した。この抗体を利用してKIF4蛋白の細胞内局在を調べた。マウス繊維芽細胞由来のL細胞は高いレベルでKIF4を発現しているので、L細胞を抗KIF4抗体で染めてみた。間期の細胞では繊維状及びパッチ状の染色が見られ、細胞質全体にも染色が見られた。また、ほとんどの細胞で核も染まっていた。共焦点顕微鏡による観察ではパッチ状の染色は幾つかの膜小器官に相当し、繊維状の染色は微小管に沿った局在を示していた。この観察よりKIF4が微小管に依存したモーターであり、間期の細胞で膜小器官を輸送していると考えられる。実際、細胞下分画では半分以上のKIF4がマイクロソーム画分に回収された。 9.分裂期の細胞では分裂装置に沿った染色と細胞質中のパッチ状の染色が見られた。パッチ状の染色は間期の細胞と同様に膜小器官であると考えられる。また、分裂装置の染色は紡錘糸微小管に沿って局在していることから、次の二つの可能性が考えられる。つまり、KIF4は分裂のモーターとして紡錘糸微小管相互の滑べり運動を担っているか、或いは、KIF4は紡錘糸微小管に沿って存在する膜小器官を輸送しているのであろう。 10.KIF4は幼若な神経細胞で有為な発現を示していたので、神経に分化させたP19細胞における細胞内局在を調べた。レチノイン酸で神経細胞に誘導した細胞において、KIF4は伸長中の突起と成長円錘に検出された。高倍率で成長円錘を観察すると、微小管に沿った繊維状の染色とパッチ状の染色が見られた。従って、KIF4は幼若な神経細胞においても一般的な細胞と同様に膜小器官と結合し、微小管に沿った輸送を行うと考えられる。 以上についてまとめると、KIF4は1)N末端モータードメイン型の新しいキネシンスーパーファミリー蛋白である。2)微小管のプラス端方向に移動する微小管依存性のモーター蛋白である。3)神経系を含んだ幼若な組織に発現し、発生時期によりその発現は制御される。4)一般の細胞及び幼若な神経細胞の両者において膜小器官と結合し、微小管に沿った順行性の輸送を行う可能性が示された。 従って、本論文は、未知のモーター蛋白の特性を明らかにし、神経細胞内膜小器官輸送の機構の解明に重要な貢献を果たすと考えられ、学位の授与に値するものと考えられる。 |