典型的な神経細胞は多数の樹状突起、細胞体および一本の長い軸索突起からなっている。この軸索突起の中には蛋白を合成する機構がほとんど存在しないので軸索内およびシナプス内に存在している蛋白質などは細胞体で合成されてからそこに運ばれなければならない。輸送される蛋白のうち大多数は違った種類の膜小器官中に含まれて速い軸索輸送(200-400mm/day)によって二方向性(順行性および逆行性)に運ばれている。ごく一部の蛋白質例えば細胞骨格の構成蛋白などは遅い軸索輸送(0.5-2mm/day)によって軸索突起内へ運ばれている。電子顕微鏡的研究では、神経細胞の軸索突起の中では微小管と膜小器官の間に明確な架橋構造が認められている。これが速い軸索輸送の構造的基礎を成している。最近になってキネシン(kinesin)と脳ダイニン(brain dynein,cytoplasmic dynein or MAP 1C:微小管関連蛋白1C或いは細胞質ダイニンとも呼ばれる)の二つの微小管により活性化されるATP酵素が各々順行性および逆行性輸送の分子モーターの候補として挙げられている。この仮説は坐骨神経の結札実験により裏付けられている。キネシンは結札部位の近位端即ち順行性に動く膜小器官に結合しており、それが順行性モーターであることを強く示唆している。一方、脳ダイニンは結札の近位端と遠位端の両方即ち順行性および逆行性の両方行に動く膜小器官に結合しており、脳ダイニンはまず膜小器官について順行性に神経終末まで運ばれそこで活性化されて逆行性モーターとして機能することと考えられる。キネシン分子の分子構造および機能ドメインに関する研究は盛んに行われておりすでに解明されてつつあるが、脳ダイニンの具体的な一次構造的な研究でさえまだ成されていない。脳ダイニンが膜小器官を運ぶメカニズムを解明し、それの機能をさらに究明するためには脳ダイニン分子の分子生物学的研究は不可欠である。故に我々はまずダイニン分子重鎖の一次的構造を決定することにした。 脳(或いは細胞質)ダイニンATP酵素は二本の410KDの重鎖、三つの74KDの中間鎖、及び一個ずつの59KD、57KD、55KD、53KDの軽鎖より構成されているとされている。我々はまず成年ラットの肝臓より、ダイニン分子がATP非存在下で超遠心により微小管と共沈する特性を利用してダイニン分子を分離した。次に高塩濃度及びATP存在下でダイニン分子を微小管よりはがす。さらにこのダイニン分子を含も上清を庶糖濃度勾配遠心を行ってダイニン分子をさらに精製した。最後に精製したダイニン分画をSDS-PAGEで分離し、ダイニン重鎖を含むゲルを切り出してlysyl-C endopeptidaseで部分分解を行った。次にこのpeptide断片を含む溶液を逆相chromatographyで展開し、単一なpeakを回収し、それのアミノ酸配列を決定した。 さらに決定したアミノ酸配列の最も長い断片の両端の配列に基づいてdegenerate oligonucleotide primerを合成しラット脳よりmRNAを精製してRT-PCR(Reverse Transcriptase-Polymerase Chain Reaction)を行った。次にこのPCR産物をplasmidにsubcloningして核酸配列を決定したところ、もとのpeptide断片の配列と完全に一致したのでこのPCR産物をprobeにしてラットの脳cDNAライブラリーのscreeningを始めた。 最初に使用したcDNAライブラリーは、先のRT-PCRを行った下流のprimerを利用して作成したextension libraryである。これより取れたクローンの5’端の配列を利用してさらにextension libraryを作った。同様な方法で二度extension libraryを作成して最終的にダイニン分子重鎖の5’non coding regionまで到達した。一方3’部分はrandom-primed cDNA libraryやoligo(dT)-primed libraryでpoly(A)まで戻した。 核酸配列が決定されたcloneの全長は15,599bpで、この中には一つの13,932bpの連続したopen reading frameを含んでいる。このopen reading frameは4,644個のアミノ酸をcodeしており、計算上の分子量は532KDである。このダイニン重鎖のほぼ真ん中の部位に四つのp-loop或はATP binding siteと呼ばれるconsensus配列(GXXXXGKT/S)が存在している。二次構造予測では脳ダイニン重鎖のC末の三分の一の部分に二つの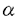 -helixを予測する部分が存在している(aa3,171-3,285とaa3,409-3,494)。中では、後者が特徴的な -helixを予測する部分が存在している(aa3,171-3,285とaa3,409-3,494)。中では、後者が特徴的な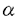 -helical coiled-coil構造を示している。この部分は恐らく脳ダイニン重鎖の二量体の形成や脳ダイニン重鎖と中間鎖及び軽鎖との間のinteractionに関わっている部分だと考えられる。 -helical coiled-coil構造を示している。この部分は恐らく脳ダイニン重鎖の二量体の形成や脳ダイニン重鎖と中間鎖及び軽鎖との間のinteractionに関わっている部分だと考えられる。 次にラット脳ダイニン重鎖をすでに発表されているウニの鞭毛ダイニン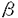 鎖や細胞性粘菌Dictyosteliumの細胞質ダイニン重鎖の一次構造と比較した。三者ともに真ん中の部分に四つのp-loop consensus sequenceを持っている。しかし、ウニの鞭毛ダイニン 鎖や細胞性粘菌Dictyosteliumの細胞質ダイニン重鎖の一次構造と比較した。三者ともに真ん中の部分に四つのp-loop consensus sequenceを持っている。しかし、ウニの鞭毛ダイニン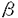 鎖とは違って、ラット脳ダイニン重鎖は細胞性粘菌の細胞質ダイニン重鎖と同じくN末側に五つ目のp-loop sequenceを持っていない。これが脳や細胞質ダイニンと鞭毛ダイニンとの機能的違いを反映している。さらにGCG ProgramのBESTFITを利用してそれぞれ比較したところ、ラット脳ダイニン重鎖とDictyostelium細胞質ダイニン重鎖とは54%と高い相同性を示しているが、ウニ鞭毛ダイニン 鎖とは違って、ラット脳ダイニン重鎖は細胞性粘菌の細胞質ダイニン重鎖と同じくN末側に五つ目のp-loop sequenceを持っていない。これが脳や細胞質ダイニンと鞭毛ダイニンとの機能的違いを反映している。さらにGCG ProgramのBESTFITを利用してそれぞれ比較したところ、ラット脳ダイニン重鎖とDictyostelium細胞質ダイニン重鎖とは54%と高い相同性を示しているが、ウニ鞭毛ダイニン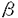 鎖は細胞性粘菌の細胞質ダイニン重鎖やラット脳ダイニン重鎖とはそれぞれ28%と27%、と比較的低い相同性を示している。進化的にラットと細胞性粘菌が、ラットとウニよりも遠いにもかかわらずそれぞれの脳や細胞質ダイニン重鎖が鞭毛ダイニンに比べて高い相同性を示していることは脳や細胞質ダイニンが鞭毛ダイニンとはcounterpartではなく、細胞内でまったく違った機能をしていることを強く示唆している。 鎖は細胞性粘菌の細胞質ダイニン重鎖やラット脳ダイニン重鎖とはそれぞれ28%と27%、と比較的低い相同性を示している。進化的にラットと細胞性粘菌が、ラットとウニよりも遠いにもかかわらずそれぞれの脳や細胞質ダイニン重鎖が鞭毛ダイニンに比べて高い相同性を示していることは脳や細胞質ダイニンが鞭毛ダイニンとはcounterpartではなく、細胞内でまったく違った機能をしていることを強く示唆している。 Dot Matrix Plot比較ではラット脳ダイニン重鎖と細胞性粘菌の細胞質ダイニン重鎖とは全長にわたって相同性を示しているのに対してラット脳ダイニンとウニ鞭毛ダイニンとはC末の三分の二(aa 1,500-4,644)では比較的高い相同性を示すが、N末の三分の一(aa 1-1,500)ではほとんど相同性を示していない。このN末の一次構造的な違いは、この部分がそれぞれの分子の細胞内で違う機能(例えば細胞内膜小器官の輸送や鞭毛の運動など)をするのに大きな役割を果たしていることを示唆している。真ん中の三分の一の部分(aa1,500-3,000)では最も高い相同性を示している。この部分には四つのp-loop consensus sequenceが含まれている。中では最もN末側のp-loop sequenceがラットや細胞性粘菌の脳や細胞質ダイニンとウニの鞭毛ダイニンの三者では完全に一致している(GPAGTGKT)。この最初のp-loop consensus regionがダイニンATP酵素のATP結合部位としての最も有力な候補である。 最後に我々Genomic Southern Blot及びラット脳の発生上各段階での脳ダイニン重鎖のNorthern Blotを行った。Genomic Southern Blotでは脳ダイニン重鎖はsingle bandを認め、ラット脳ダイニン重鎖の遺伝子はsingle geneであることが分かった。 Northern Blotでは脳と肝臓よりともに〜16kbの高さに一本のbandが認められているが、肝臓では脳での発現量の十分の一以下である。脳の発生各段階においては生後0dayでは発現が最も高く、その後段々減少し生後10dayでは発現が最も低く五分の一程度になる。その後一旦立ち上がって生後14dayで再びpeakに達し、その後また10day程度まで下がって成年まで続く。この脳ダイニン重鎖の生後での発現パターンは軸索突起及び樹状突起の成熟、特にearly MAPsやlate MAPsの発現の移行と一致している。これにも脳ダイニンが何らかの関わりをしていることを示唆している。 我々はラット脳より脳ダイニン重鎖のcDNAのcloningに成功した。cloningされたcDNAの全長は15,599bpで13,932bpのopening reading frameを含んでおり、4,644アミノ酸残基をcodeしており、分子量は532KDである。N末の三分の一の部分は鞭毛ダイニンと相同性を示さず脳ダイニンと鞭毛ダイニンとの機能的な違いを示唆している。真ん中の三分の一には四つのATP binding site(或はp-loop)が存在しており、この部分がダイニンATP酵素の機能部位である。C末の三分の一には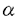 -heliccal coiled-coilを予測する部分があり、この部分がダイニン分子が大きなcomplexを形成する構造的な基礎をなしている。 -heliccal coiled-coilを予測する部分があり、この部分がダイニン分子が大きなcomplexを形成する構造的な基礎をなしている。 |