タンパク質は、生体の中でその結合水とともに立体構造を保ち、機能を発揮している。タンパク質そのものの構造や機能をモニタリングする方法は多数あるが、まわりの環境も含めたタンパク質のはたらきを理解するためには結合水も含めてモニタリングする必要がある。 タンパク質の生理活性を保った状態で結合水も含めて測定する方法としては、NMR(Nuclear Magnetic Resonance)の緩和時間測定と低周波のマイクロ波分光の2つがあり、この手法は互いに相補な関係にある。NMRではタンパク質の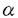 一炭素鎖のゆらぎや結合水の交換速度や量が求められてきたし、マイクロ波分光ではタンパク質の溶液中での回転や結合水の量、水分子の回転運動が測定されてきた。タンパク質の熱変性など物性的な測定は両方の手法ですでになされている。 一炭素鎖のゆらぎや結合水の交換速度や量が求められてきたし、マイクロ波分光ではタンパク質の溶液中での回転や結合水の量、水分子の回転運動が測定されてきた。タンパク質の熱変性など物性的な測定は両方の手法ですでになされている。 タンパク質には他の分子を認識し結合することで生理的機能を発揮するものがある。他の分子を認識しているときとそうでないときの違いは、例えばカルシウム受容タンパクの1つであるカルモジュリンなどがNMRによって測定されている。しかしマイクロ波分光によるタンパク質の分子認識の測定はこれまでに報告されていない。 そこで本研究では、分子認識を行うタンパク質を測定対象としてマイクロ波分光を用いて結合水も含めた測定を行った。 測定するタシパク質を選ぶ際に、測定上の制限により次の2つの点を考慮した。1つは他の分子を認識してできる結合体がX線で構造決定されていること、2つは認識される分子の分子量がタンパク質に比べてはるかに小さいことである。この2つの条件は測定上の都合によるものである。 マイクロ波分光による測定では、試料中のタンパク質のうちの何割かが分子と結合している状態の時間平均を測定している。従って酵素反応のような溶液全体の反応がミリ秒のオーダーで終了する現象をリアルタイムに測定することはできない。1回の測定に数分かかるので、繰り返し測定を行うには、タンパク質が室温で数時間安定でなければならない。 マイクロ波分光の測定では、分子の持つ双極子モーメントの回転というエネルギーの低い運動を観測しているために測定感度が低いので、低分子の稀薄溶液は溶媒と区別できない。この低感度性を逆に利用すれば、タンパク質に結合する分子が測定にとって希薄ならばその分子の存在は無視できるので、得られたスペクトルの差がそのままタンパク質の状態の差になる。1回の測定に必要なタンパク質の量は10mg以上なので、十分な実験をするためにはタンパク質の入手が容易でなければならない。 また結合状態とそうでない状態の立体構造がわかっていれば、得られたスペクトルの結果の説明をつけやすい。 そこで、認識に際してタンパク質の形がほとんど変わらないものとしてリゾチームによるN-アセチルグルコサミン((NAG)3)の3量体の認識と、pH依存の測定を行った。結合に際してタンパク質の形が大きく変わる系として、ヘキソキナーゼとグルコースの組み合わせ、ホスホリラーゼbとAMPの組み合わせを選んだ。また、イオンを認識するタンパク質としてパルブアルブミンを選んだ。 比較のためにタンパク質の一部が切れて活性化されるトリプシノーゲンと活性化後のトリプシンの測定を行った。トリプシンは同じような活性化をされる他のタンパク質と比べると活性化前後の分子量の差がアミノ酸6残基と小さい。 吸収スペクトルの測定手法として、TDR(Time Domain Reflectometry)を用いた。 マイクロ波の吸収スペクトルは、試料の複素誘電率の虚部になる。吸収のあるところで誘電緩和が起こり、吸収スペクトルのピークの大きさは緩和強度と対応する。ここではTDRを用いて、試料の複素誘電率のスペクトルを求めることで、マイクロ波の吸収スペクトルを得た。 TDRでは、立ち上がりが数10ピコ秒で200mVのパルス電場を試料に印加し、反射波の波形を時間領域で測定し、フーリエ変換などを行うことで、1回の測定で2桁以上の周波数範囲の複素誘電率のスペクトルを得ることができる。4桁にわたる周波数範囲で測定するためにサンプルセルを交換し、レンジを変えて測定を行った。 測定の結果以下のことがわかった。 リゾチームでは、(NAG)3の結合によってタンパク質自身の緩和強度が増加したが、結合水は変化しなかった。タンパク質自身の緩和強度の増加は、pH7.8の時の方がpH5.3の時より大きかった。(NAG)3の結合によって結合部位の電荷密度が増加するというX線散乱の結果を考慮すると、このことがタンパク質自身の緩和強度の増加をひきおこしていると考えられる。 リゾチームのみのスペクトルから、pH5.3の時の方がタンパク質自身の緩和強度も結合水の緩和強度も大きいことがわかった。pHの変化によって、アミノ酸残基の電離の状態が変化するために、タンパク質自身の電気双極子の大きさや結合水の量が変化する。リゾチームの場合は、等電点が11であり、pHがこの値から離れるほどタンパク質自身が持つ電荷が大きくなる。このためタンパク質の電気双極子が大きくうなり、緩和強度が増加したと考えられる。また、電離しているアミノ酸残基の数が増えたために結合水の量が増加したと解釈できる。 ヘキソキナーゼではグルコースの結合により、タンパク質と結合水の緩和強度がともに減少した。パルブアルブミンでもカルシウムイオンの結合により、タンパク質と結合水の緩和強度が減少した。これらのタンパク質は分子やイオンの結合によって変形し、タンパク質の空間的な大際が小さくなる。変形によってアミノ酸残基間の距離が小さくなれば、タンパク質の電気双極子の大きさが小さくなり、タンパク質の表面積も減少するので結合水の量が減少する。このためにタンパク質と結合水の緩和強度の現象が起きたと考えられる。 ホスホリラーゼbでは、結合水の変化はほとんどなかった。ホスホリラーゼbは4つのサブドメインを持ち、AMPの結合によって4つのドメインの位置がずれる。この変形による表面積の変化は、クレフト部分が閉まるような変形の時にくらべて小さいことが考えられた。 トリプシンとトリプシノーゲンのスペクトルを比較し、タンパク質自身の緩和強度も結合水の緩和強度もトリプシンの方が大きいことがわかった。特に結合水の緩和強度はフィッティングで得られた値で比較するとトリプシンの方が約2倍であった。トリプシンの活性部位のクレフトに沿って大量の結合水が存在するという中性子散乱の結果を考慮すると、トリプシノーゲンが活性化されるときにクレフトが開いて、そこに水分子が結合してくることが考えられた。 以上、要するに本研究では、タンパク質の分子認識の結合水の変化も含めたマイクロ波分光による観察により、認識によってタンパク質の形状が変わらないとき結合水が変化しないこと、およびタンパク質の形状が変わるとき結合水の変化を伴うことを明らかにした。認識される分子との結合によりタンパク質自身の緩和強度はタンパク質の変形の有無にかかわらず変化することを観察した。なお、pHを変化させたときはタンパク質の緩和強度も結合水の緩和強度も共に変化するという結果を得た。 |