種々のGタンパク質共役型受容体がアゴニスト依存性にリン酸化されることが知られている。このリン酸化は受容体の脱感受性に関係すると考えらる。受容体の脱感受性機構はGタンパク質との脱共役、受容体が細胞表面から細胞内に移動する細胞内移行、受容体量が減少するダウンレギュレーションに分けられる。受容体のリン酸化と脱感受性との関係についてはGsと共役する 2アドレナリン受容体及び視細胞の光受容体であるロドプシンについて多くの研究がなされている。 2アドレナリン受容体及び視細胞の光受容体であるロドプシンについて多くの研究がなされている。 2アドレナリン受容体はGタンパク質共役受容体キナーゼ2(= 2アドレナリン受容体はGタンパク質共役受容体キナーゼ2(= adrenergic receptor kinase 1,GRK2)等によりアゴニスト依存性にそのC末部分がリン酸化される。リン酸化された adrenergic receptor kinase 1,GRK2)等によりアゴニスト依存性にそのC末部分がリン酸化される。リン酸化された 2アドレナリン受容体に 2アドレナリン受容体に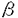 アレスチンが結合することによって、Gタンパク質Gsとの結合が阻害され脱共役が起こる。また、ロドプシンキナーゼ(=GRK1)によりリン酸化されたロドプシンにアレスチンが結合し、ロドプシンとGタンパク質Gtとの脱共役が起こる。 アレスチンが結合することによって、Gタンパク質Gsとの結合が阻害され脱共役が起こる。また、ロドプシンキナーゼ(=GRK1)によりリン酸化されたロドプシンにアレスチンが結合し、ロドプシンとGタンパク質Gtとの脱共役が起こる。 Giと共役するムスカリン性アセチルコリン受容体m2サブタイプ(以下m2受容体)もGRK2によりアゴニスト依存性にリン酸化される。そのリン酸化はアゴニスト結合受容体及びGタンパク質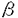 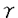 サブユニットにより活性化され、リン酸化部位は第三細胞内ループ中央部分にあることが示された。一方、m2受容体の第三細胞内ループ中央部分を欠損させた変異体ではアゴニスト刺激による細胞内移行が抑制されることが示された。この欠損部位はGRK2によるリン酸化部位を含むことから、GRK2によるリン酸化は受容体の細胞内移行に関わっている可能性が考えられた。本研究はこの仮説を証明するためにおこなった サブユニットにより活性化され、リン酸化部位は第三細胞内ループ中央部分にあることが示された。一方、m2受容体の第三細胞内ループ中央部分を欠損させた変異体ではアゴニスト刺激による細胞内移行が抑制されることが示された。この欠損部位はGRK2によるリン酸化部位を含むことから、GRK2によるリン酸化は受容体の細胞内移行に関わっている可能性が考えられた。本研究はこの仮説を証明するためにおこなった m2受容体の細胞内におけるリン酸化実験は以下の通り行った。COS-7細胞にMycの部分パプチドからなるタグをN末部分に結合させたm2受容体とGRK2、または酵素活性を持たないGRK2の変異体DN-GRK2(GRK2K220W)とを共発現させた。この細胞を[32P]無機リン酸により標識し、10-5Mカルバミルコリンで20分刺激したのち、細胞の膜分画を可溶化し、m2受容体をMycの部分パプチドに対するモノクローナル抗体で沈降させた。免疫沈降された受容体をSDS-PAGEにより分離した後、ゲルのオートラジオグラフィーをおこなった。細胞内移行の測定実験は以下の通り行った。COS-7細胞及びBHK-21細胞にm2受容体及びGRK2またはDN-GRK2を発現させ、カルバミルコリン刺激後の細胞表面の受容体量の減少を細胞膜を通過しないリガンドである[3H]NMSの結合活性の消失で測定した。 m2受容体はアゴニスト依存性にリン酸化された。またGRK2の共発現によってリン酸化量は約3倍に増加し、DN-GRK2の共発現により約4分の1に減少した。この阻害作用から、DN-GRK2はCOS-7細胞にもともと存在する受容体リン酸化酵素の作用に対してドミナントネガティブに働くと推察される。m2受容体を発現させたCOS-7細胞を10-5M以上の濃度のカルバミルコリンで刺激すると、2時間後に約40%の受容体が細胞内に移行した。GRK2を共発現させた細胞では10-7Mの濃度から細胞内移行が観察されるようになり、10-6Mカルバミルコリン2時間刺激後では30-35%の受容体が細胞内に移行した。DN-GRK2を共発現させた細胞では10-5Mカルバミルコリン2時間刺激後のm2受容体の細胞内移行は約20%に減少した。BHK-21細胞でも10-5M以上のカルバミルコリン刺激により細胞内移行が観察されたが、その程度はCOS-7に比べて低く、2時間刺激後に約20%であった。GRK2を共発現した細胞では細胞内移行はカルバミルコリン濃度10-7Mから観察され、10-5M2時間刺激では約35-40%のm2受容体が細胞内に移行した。しかしDN-GRK2共発現による阻害は観察されなかった。 以上の結果から、m2受容体の細胞内移行には、GRK2によるリン酸化が重要な役割をしていると考えられる。DN-GRK2の実験結果からCOS-7細胞では、内在性のGRK2あるいは類似のリン酸化酵素がm2受容体のリン酸化及び細胞内移行に関わっていることが推察される。 |