ras遺伝子ははじめ、レトロウイルス中の癌遺伝子として同定された。その後細胞性ras遺伝子の存在が発見され、ras遺伝子はすべての真核細胞に広く分布していることが明らかにされた。また、ヒト固形癌の約30%においてras遺伝子の活性型変異がみいだされている。Rasタンパク質は種々の細胞において、増殖あるいは分化のシグナル伝達系で機能しており、NIH3T3などの繊維芽細胞では、EGFやPDGFなどの増殖因子がひきおこす細胞増殖、一方ラット褐色細胞腫PC12細胞では、NGFなどの分化因子による交感神経様細胞への分化の誘導に重要な役割を果たしている。Rasタンパク質は低分子量型GTP結合タンパク質の一種で、その活性は結合グアニンヌクレオチドによって制御されている。GTP結合型は活性型であり、下流のエフェクター分子を活性化する。一方、GDP結合型は上流のグアニンヌクレオチド交換因子と相互作用を行っている。 T細胞はT細胞受容体(TCR)に対する抗原の結合により活性化され、IL-2などのリンフォカインの生産と細胞増殖が誘導される。このT細胞活性化の過程においても、Rasがシグナル伝達因子として機能していることが知られている。本研究では、T細胞活性化のシグナル伝達系におけるRasの役割を明らかにした。また、Gs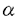 ,cAMPを介したシグナル伝達系による抑制的なクロストークについても検討を加えた。 ,cAMPを介したシグナル伝達系による抑制的なクロストークについても検討を加えた。 まずヒトT細胞株Jurkatにおいて、Rasの活性化を引き起こすシグナル伝達系の解析を行った。TCRを活性化するphytohemaggulutinin(PHA)、抗CD3抗体(OKT3,SPVT3bなど)、あるいはプロテインキナーゼC(PKC)を直接活性化するphorbol myristate acetate(PMA)でJurkat細胞を刺激すると、GTP結合型Rasの増加が認められた。この際のGTP結合型の割合は、刺激前の細胞では3-4%であるのに対して、TCR刺激では約5倍の15-20%、PMA刺激では約10倍の40%に増加した。TCRによるRasの活性化は一過的で、OKT3添加後約5分後に最高値に達し、30分後には刺激前の値に戻った。T細胞でのRasの活性化の情報伝達系においても、チロシンキナーゼが関与しているかどうかを検討するために、チロシンキナーゼの阻害剤herbimycin Aの効果を検討した。その結果、TCRを介するRas・GTPの増加はherbimycin Aの前処理により濃度依存的に阻害され、1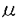 g/mlでほぼ完全に抑えられたが、PMA刺激によるRasの活性化は阻害されなかった。このことから、TCRを介するRasの活性化においても、チロシンキナーゼが重要な役割を果たしていることが示唆された。次にTCR、チロシンキナーゼによるRasの活性化と、PKCによるRasの活性化の関係を明らかにするために、PKCの阻害剤Calphostin Cの前処理、またはPMAで長時間処理によるPKCのダウンレギュレーションの効果を調べた。その結果、PKCを介するRasの活性化及び、TCRを介するRasの活性化の両方がほとんど阻害された。以上の結果よりJurkat細胞では、繊維芽細胞の系でよく知られているチロシンキナーゼ→アダプター→グアニンヌクレオチド交換因子→Rasという系とは別に、TCR→チロシンキナーゼ→ホスフォリパーゼC- g/mlでほぼ完全に抑えられたが、PMA刺激によるRasの活性化は阻害されなかった。このことから、TCRを介するRasの活性化においても、チロシンキナーゼが重要な役割を果たしていることが示唆された。次にTCR、チロシンキナーゼによるRasの活性化と、PKCによるRasの活性化の関係を明らかにするために、PKCの阻害剤Calphostin Cの前処理、またはPMAで長時間処理によるPKCのダウンレギュレーションの効果を調べた。その結果、PKCを介するRasの活性化及び、TCRを介するRasの活性化の両方がほとんど阻害された。以上の結果よりJurkat細胞では、繊維芽細胞の系でよく知られているチロシンキナーゼ→アダプター→グアニンヌクレオチド交換因子→Rasという系とは別に、TCR→チロシンキナーゼ→ホスフォリパーゼC-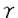 1(PLC- 1(PLC-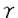 1)→PKC→Rasというシグナル伝達経路が存在し、TCRを介したRasの活性化には後者の方の寄与が大きいと考えられる。 1)→PKC→Rasというシグナル伝達経路が存在し、TCRを介したRasの活性化には後者の方の寄与が大きいと考えられる。 次にT細胞活性化におけるRasの役割を明らかにする目的で、PHAやPMAでT細胞を刺激した時のIL-2の発現と、その際のRasの効果について検討した。IL-2の発現は、IL-2プロモーターの下流にルシフェラーゼ遺伝子を連結したもの(IL-2 Luciferase)をレポーター遺伝子として用いて検討した。Jurkat細胞をPMAとPHAまたはPMAとカルシウムイオノフォア(A23187)の組み合わせで刺激すると、IL-2プロモーターの活性化が観察された。このとき同時に活性型変異体Ras(12G→V)を発現させると、IL-2プロモーターの活性化が増強された。これに対し、Rasの優性抑制的(dominant-negative)変異体(17S→N)は、IL-2プロモーターの活性化に対し抑制効果を示した。以上の結果から、Rasの活性化はIL-2の発現に必須であり、T細胞活性化の際にTCRからのシグナルの伝達因子として機能していることが示唆された。 コレラ毒素はNADを基質として、Gs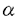 をADPリボシル化する。ADPリボシル化されたGs をADPリボシル化する。ADPリボシル化されたGs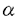 はGTPase活性が低下し、その結果アデニル酸シクラーゼを恒常的に活性化し細胞内cAMP濃度の上昇を引き起こす。T細胞をコレラ毒素で処理すると、細胞質へのカルシウムの流入や、IL-2の生産が抑制されることが知られている。そこでJurkat細胞を用いてコレラ毒素の効果を検討したところ、細胞をあらかじめコレラ毒素で処理すると、種々の刺激によるIL-2プロモーターの活性化が消失することが確認された。さらにIL-2 Luciferase遺伝子とともに活性型変異体Gs はGTPase活性が低下し、その結果アデニル酸シクラーゼを恒常的に活性化し細胞内cAMP濃度の上昇を引き起こす。T細胞をコレラ毒素で処理すると、細胞質へのカルシウムの流入や、IL-2の生産が抑制されることが知られている。そこでJurkat細胞を用いてコレラ毒素の効果を検討したところ、細胞をあらかじめコレラ毒素で処理すると、種々の刺激によるIL-2プロモーターの活性化が消失することが確認された。さらにIL-2 Luciferase遺伝子とともに活性型変異体Gs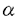 (213Q→L)を組み込んだ発現ベクター(pCMVGsQL)を細胞に導入すると、IL-2プロモーターの活性化がpCMVGsQLの濃度に依存して抑制された。このことからコレラ毒素による阻害効果は、Gs (213Q→L)を組み込んだ発現ベクター(pCMVGsQL)を細胞に導入すると、IL-2プロモーターの活性化がpCMVGsQLの濃度に依存して抑制された。このことからコレラ毒素による阻害効果は、Gs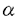 の活性化に基ずくものであり、おそらく本来何らかのレセプターを介して、Gs-アデニル酸シクラーゼ系を制御しているシグナルを反映しているものと考えられた。そこで本研究では、その作用点がRasを介するT細胞活性化シグナルのどこに位置するのかを解析した。 の活性化に基ずくものであり、おそらく本来何らかのレセプターを介して、Gs-アデニル酸シクラーゼ系を制御しているシグナルを反映しているものと考えられた。そこで本研究では、その作用点がRasを介するT細胞活性化シグナルのどこに位置するのかを解析した。 IL-2の発現にはRasの活性化が必須であることが明らかになったので、まずRasの活性化に対するコレラ毒素の効果を検討したところ、TCR刺激によるRasの活性化はコレラ毒素によって阻害されたが、PMA刺激によるRas・GTPの増加は阻害されなかった。TCRを介したRasの活性化では、TCR→チロシンキナーゼ→PLC-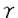 1→PKC→Rasというシグナル伝達経路が主要であることから、TCRとPKCの間に一つ作用点があると考えられた。そこでT細胞の活性化において重要な役割を果たしているチロシンキナーゼであるZAP-70、およびPLC- 1→PKC→Rasというシグナル伝達経路が主要であることから、TCRとPKCの間に一つ作用点があると考えられた。そこでT細胞の活性化において重要な役割を果たしているチロシンキナーゼであるZAP-70、およびPLC-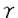 1のチロシンリン酸化に対するコレラ毒素の効果について検討を加えた。Jurkat細胞をSPVT3bあるいはPHAで刺激すると、ZAP-70およびPLC- 1のチロシンリン酸化に対するコレラ毒素の効果について検討を加えた。Jurkat細胞をSPVT3bあるいはPHAで刺激すると、ZAP-70およびPLC-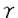 1が抗ホスフォチロシン抗体によって免疫沈降されたが、細胞をあらかじめコレラ毒素で処理すると、抗ホスフォチロシン抗体によってZAP-70、PLC- 1が抗ホスフォチロシン抗体によって免疫沈降されたが、細胞をあらかじめコレラ毒素で処理すると、抗ホスフォチロシン抗体によってZAP-70、PLC-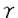 1は免疫沈降されなかった。次にこれらの情報伝達分子及びPKCのTCR刺激に依存した細胞内における局在の変化と、そのときのコレラ毒素の効果について検討した。細胞を抗CD3抗体によって刺激すると、ZAP-70およびPLC- 1は免疫沈降されなかった。次にこれらの情報伝達分子及びPKCのTCR刺激に依存した細胞内における局在の変化と、そのときのコレラ毒素の効果について検討した。細胞を抗CD3抗体によって刺激すると、ZAP-70およびPLC-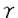 1の、細胞内での可溶画分から膜画分への移行が観察され、さらにPKCの一過的な膜画分への移行も観察された。一方、PMAはZAP-70及びPLC- 1の、細胞内での可溶画分から膜画分への移行が観察され、さらにPKCの一過的な膜画分への移行も観察された。一方、PMAはZAP-70及びPLC-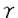 1の膜画分への局在化を促進しなかったが、PKCの膜画分への移行を強く促進した。この際にコレラ毒素は、ZAP-70、PLC- 1の膜画分への局在化を促進しなかったが、PKCの膜画分への移行を強く促進した。この際にコレラ毒素は、ZAP-70、PLC-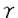 1、PKCのTCR刺激に依存した細胞内での可溶画分から膜画分への移行は阻害したが、PMA刺激によるPKCの膜画分への移行は阻害しなかった。すなわちコレラ毒素は、TCR刺激によるZAP-70、PLC- 1、PKCのTCR刺激に依存した細胞内での可溶画分から膜画分への移行は阻害したが、PMA刺激によるPKCの膜画分への移行は阻害しなかった。すなわちコレラ毒素は、TCR刺激によるZAP-70、PLC-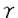 1のチロシンリン酸化や、それに伴うタンパク質間相互作用を特異的に阻害していると考えられる。従ってT細胞では、Gタンパク質、アデニル酸シクラーゼを介するシグナル伝達系が、TCR→チロシンキナーゼ→PLC- 1のチロシンリン酸化や、それに伴うタンパク質間相互作用を特異的に阻害していると考えられる。従ってT細胞では、Gタンパク質、アデニル酸シクラーゼを介するシグナル伝達系が、TCR→チロシンキナーゼ→PLC- 1→PKC→Rasという経路に対して抑制的にクロストークを行なっている可能性が示唆された。現在、Rasから遺伝子発現に至る経路におけるクロストークの可能性についても検討中である。 1→PKC→Rasという経路に対して抑制的にクロストークを行なっている可能性が示唆された。現在、Rasから遺伝子発現に至る経路におけるクロストークの可能性についても検討中である。 |