学位論文要旨
| No | 111343 | |
| 著者(漢字) | 村本,和世 | |
| 著者(英字) | ||
| 著者(カナ) | ムラモト,カズヨ | |
| 標題(和) | 培養大脳皮質ニューロン間のシナプス形成機構の解析 | |
| 標題(洋) | ||
| 報告番号 | 111343 | |
| 報告番号 | 甲11343 | |
| 学位授与日 | 1995.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 博医第997号 | |
| 研究科 | 医学系研究科 | |
| 専攻 | 第二基礎医学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 1.はじめに:脳の高次機能は、多数のニューロン間で形成されるシナプスを介した複雑なネットワークによって営まれている。従来、成熟して後のシナプスは固定されたものとする考え方が強かったが、近年になって、シナプス結合が発生期のみならず成体においても外界の刺激に応じて変化しうることがわかってきた。従って、シナプス形成機構の解析は、発生期における問題だけではなく、成熟してからの脳機能に関連した現象の基礎としてもとても興味深い。シナプス形成のような現象を観察していくためには、薬理的な操作が容易なこと、連続的な観察が可能なことなどから培養細胞を用いた系は、非常に利点が多い。しかし、これまでは形成されたシナプスを定量的に観察することが難しかったため、実験材料として便利な培養系でも、観察の容易な突起伸展のようなシナプス形成の一過程に限定されたものにならざるをえなかった。そこで、培養系を用いて外的因子を操作した場合に、シナプス形成への影響を量的に推定することが可能なシナプス形成アッセイ系の開発を試みた。 2.方法:ラット大脳皮質の初代培養系を用いて、主に培養7日目にCa2+蛍光色素fura-2を用いた細胞内Ca2+変動多点同時計測システムにより、細胞内Ca2+の動態を観察した。培養系内にできているシナプスを電子顕微鏡による観察で確認し、計数による定量化も行なった。 3.結果及び考察:培養7日目頃、細胞内Ca2+変動多点同時計測システムを用いて観察すると、多数のニューロン間で同期した自発的細胞内Ca2+変動が認められた。この現象は、培養ニューロンの自発性の電気的興奮が、形成されたシナプスを通じて多数のニューロンに伝達していることを示している。培養系内に実際に多数のシナプスが形成されていることも、電子顕微鏡を用いた観察から明らかになった。さらに電顕による定量的解析により、培養系内で観察されるシナプスは培養日数とともに増加し、その増加の様子や形態的に成熟していく様子は、生体内の場合とよく似ていた。この時、細胞内Ca2+変動の振動数(Freq.)も、シナプス数と平行して培養日数と共に上昇した。両者の関係を調べると、強い二次相関を示すことが判明した(相関係数r=0.95)。この関係を用いれば、形成されたシナプスの数を、細胞内Ca2+変動のFreq.を見ることで推定できると思われる。環境設定の容易な培養系とできたシナプスを量的に判定できる系が揃ったため、シナプス形成に何らかの作用を持つ薬物のpreliminaryなスクリーニングが可能となった。 1.はじめに:細胞内Ca2+変動のFreq.の比較により、培養ニューロン間に形成されたシナプスの量的推定を簡便にすることができるので、早速様々な薬剤のシナプス形成に対する影響について検討した。その一つとして、細胞膜をほとんど透過しないプロテイン・キナーゼ阻害剤K-252bにより、シナプス形成が阻害されることが判明した。 2.方法:細胞内に透過しないプロテイン・キナーゼ阻害剤K-252bを培養開始日より培養液に加え、7日後細胞内Ca2+変動多点同時計測システムを用いて観察した。さらに電顕観察により、シナプス数の変化を最終的に確認した。 3.結果及び考察:K-252bを加えて培養7日目、細胞内Ca2+変動を観察すると、無添加群に比べてK-252b添加群は濃度依存的に細胞内Ca2+変動のFreq.の低下を示した。すなわち、形成されたシナプス数が少ないことが推定された。シナプス数が少ないことは、電顕による定量的観察で確認された。この結果、K-252bはシナプス形成阻害作用をもつことが判明した。近年、細胞膜の外側に触媒活性を持つ蛋白質リン酸化酵素(エクト・キナーゼ)の存在がニューロブラストーマなどの膜表面で報告されているが、K-252bの阻害標的分子は阻害剤の作用特性よりエクト・キナーゼである可能性がある。ラット大脳皮質培養細胞表面にエクト・キナーゼが存在し、シナプス形成過程に関与していると考えられる。 1.はじめに:リン酸化酵素阻害剤K-252bの膜を透過しない性質から、阻害されるリン酸化は細胞外で起こっていると考えられた。様々な細胞の膜外表面に、蛋白質の細胞外ドメインをリン酸化するエクト・キナーゼが存在することが報告されている。従って、K-252bの処理によってシナプス形成が抑制されるのは、培養ラット大脳皮質細胞に存在するエクト・キナーゼ活性を阻害した結果の可能性がある。そうすると、リン酸化基質蛋白質(群)は、培養大脳皮質ニューロン間のシナプス形成において非常に重要な役割を果たしていると思われる。そこで、培養ラット大脳皮質細胞にエクト・キナーゼ活性が存在するかどうかを検討し、基質蛋白質の同定を行った。さらに、得られた基質について、若干の解析を加えた。 2.方法:蛋白質の細胞外ドメインをリン酸化する条件で[ 3.結果と考察:細胞外のリン酸化を解析すると、33Pのとり込まれる複数のバンドが認められた。これらのバンドのリン酸化は、反応開始の時間経過が速く、K-252bによって阻害を受けるため、細胞外のものと考えられた。K-252bは、シナプス形成とリン酸化反応の両者を阻害したため、基質となる蛋白質にはシナプス形成に関与するものが必ずあると考えられた。そこで、複数の基質の中からK-252bによる阻害が強く、SDS-PAGEのみで明瞭な単一バンドとして得られた最高分子量(212KDa以上)の蛋白質を選び、その同定を試みた。プロテアーゼ処理後のHPLCで単一ピークとして得られた4つの部分ペプチドのアミノ酸配列を決定した。その結果、この蛋白質は微小管関連蛋白質MAP1Bと一致する事がわかった。コンピューターを用いた膜貫通部位予測により、MAP1Bアミノ酸配列中に1個所、明瞭な膜貫通領域の存在が示された。膜貫通の可能性を確かめるために、MAP1B分子の細胞外、内と予想される領域に対してそれぞれペプチド抗体を作成し、細胞の外側のみの染色条件・中まで染色する条件を併用して、免疫細胞染色的に検討した。その結果、細胞の外側部分に対する抗体4168-73により、細胞外染色条件によっても細胞が染色され、MAP1Bの膜貫通の可能性は高まった。MAP1Bは、その発現時期や成長錐への局在、リン酸化状態などから、ニューロンの分化(特に突起伸展)に重要な役割を果たしていると考えられてきたが、さらに細胞外ドメインが存在し、この部分のリン酸化によってシナプス形成に調節的な役割を果たしている可能性が示唆された。 1)ラット大脳皮質細胞を単離・培養すると、ニューロンは複雑な神経回路網を形成し、各ニューロンは、シナプス伝達によって同期した自発的電気活動を示した。 2)この電気活動はCa2+螢光指示薬fura-2を用いて細胞内Ca2+変動をモニターすることにより観察できる。 3)電子顕微鏡を使って、実際に形成されたシナプス数を数えると、この同期した細胞内Ca2+変動の振動数は、形成されたシナプス数と強い相関を示した。 4)すなわち、細胞内Ca2+変動の振動数の測定により、形成されたシナプス数を簡便に推定することができる。 5)この系を用い、培養初期から何らかの薬物を与えておき、一定期間後にこの方法でシナプス数の推定を行なえば、シナプス形成に影響する薬物をスクリーニングすることが可能となる。 6)一例として、細胞膜を透過しない蛋白質リン酸化酵素阻害剤K-252b添加により、シナプス形成が阻害されることが示唆された。この阻害は、電顕を用いたシナプス数の計測によって確認された。 7)K-252bの膜を透過しないという性質から、阻害剤の標的となるリン酸化は細胞外で起こっていると考えられたが、大脳皮質培養細胞膜表面にこの様なリン酸化活性が存在し、K-252bはこのリン酸化も阻害することがわかった。 8)このリン酸化反応の基質の1つを同定したところ、微小管関連蛋白質MAP1Bであることが判明した。 9)これまでの研究の流れから、MAP1Bの膜蛋白質としての可能性を再検討したところ、コンピューターによる膜貫通領域の予測、抗体による細胞の染色ともに膜貫通の可能性を示唆した。 | |
| 審査要旨 | 本研究は、ラット大脳皮質細胞の初代培養系での細胞内Ca2+同時多点観測系の開発、多数の細胞で同期して起こる細胞内Ca濃度の周期的増加に対する薬物の影響、細胞内Ca濃度の周期的増加に関与すると推測されるタンパク質リン酸化の同定、について下記の結果を得ている。 1)ラット大脳皮質細胞を培養すると、培養7日目頃より自発的な細胞内Ca2+濃度の周期的増加が多数の神経細胞間で同期して起こる(Ca2+ Oscillation)。この現象はCa2+螢光指示薬fura-2を用いて細胞内Ca2+濃度の変動をモニターすることにより観察でき、神経細胞間のシナプスを介する回路形成によると解釈されている。電子顕微鏡を使って形成されたシナプスを観察・計数すると、Ca2+ Oscillationの振動数がシナプス数と相関していた。Ca2+ oscillationに影響を及ぼす薬物はシナプス形成に影響を及ぼす薬物である可能性が考えられる。 2)タンパク質リン酸化酵素阻害剤K-252bを細胞培養外液に添加すると、Ca2+ oscillationの振動数の濃度依存的な低下・消失が観察された。K-252bは細胞膜を透過し難いという性質を持つので、阻害剤の標的はタンパク質の細胞外ドメインをリン酸化するエクト・プロテインキナーゼである可能性が考えられる。 3)ラット大脳皮質細胞の培養系に[ 4)MAP1Bのアミノ酸配列の解析の結果、膜貫通部位と推測される部分が1カ所見出された。MAP1Bのアミノ酸配列中のいくつかの領域に対する部分ペプチド抗体を用い、細胞染色法によって検討した。細胞外領域と予測される部分に対する抗体での染色では、細胞固定をほとんど行わず抗体の細胞内への透過性を高めるような界面活性剤処理も行わない染色条件下でも細胞外と考えられる染色像が得られた。これに対して細胞内と考えられる領域に対する抗体では同じ条件下で染色されなかった。これらの結果はMAP1B分子中に膜貫通領域が存在するという仮説を支持する。 以上本論文は、ラット大脳皮質の初代培養細胞系で周期的な細胞内Ca濃度変化が多数の細胞に同期して生ずること、この周期的変化が細胞内に入りにくいタンパク質キナーゼ阻害剤K-252b投与で抑制されること、この系で微小管結合タンパク質MAP1Bが細胞外に投与したATPで速やかにリン酸化され、そのリン酸化がK-252bで阻害される、という興味深い実験結果を報告している。これらの実験事実は、MAP1Bが細胞外ドメインを持ち、その部位のリン酸化がシナプス伝達もしくはシナプス形成に関与するという可能性を示唆する。この仮説そのものは証明されたわけではないが、神経生物学の基本問題の1つに対して極めて独自な見解を提起するものである。この仮説の根拠となった実験事実は大変興味深く、神経生物学に基本的な貢献をするものであり、学位の授与に値すると考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54474 |
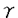 -33P]ATPを細胞外に極く短時間添加して培養細胞でのリン酸化反応を行なった。[
-33P]ATPを細胞外に極く短時間添加して培養細胞でのリン酸化反応を行なった。[