[はじめに] 細胞内ATPは細胞のエネルギー源で、その恒常性を保つために不可欠の因子であり、その減少は直接死に結びつくため細胞はあらゆる手段を用いて細胞内ATP濃度の維持に努めている。しかし、最近多くの臓器で細胞外にもATPが存在していることが報告され、Burnstockのプリナージック仮説と相俟って細胞外ATPあるいは関連ヌクレオチドの生理学的役割に注目が集まってきている。
1954年Holtonらは知覚神経逆伝導性刺激後の血管拡張に関係する化合物を検索して、脊髄の抽出物が血管拡張作用を示し、その原因物質がATPであることを示した。また、ウサギの耳介潅流標本の潅流液中に神経刺激によりATPが遊離してくることを見いだし、ATPが神経の化学伝達物質である可能性を示唆した。それ以来外から与えたATPに顕著な生理作用のあることが多くの研究者によって報告されている。
1978年Burnstockらはプリナージック受容体を、1)ATP,ADP,AMP,adenosineの相対作用強度、2)methylxanthineによる遮断の有無、3)adenylate cyclaseの活性化の有無、4)prostaglandinの合成促進の有無、の4つの基準によりP1、P2に分類した。P1受容体はadenosine>AMP>ADP>ATP,P2受容体はATP>ADP>AMP>adenosineの順に親和性を示している。P2受容体は主にATPと結合するP2XとP2Yに分けられ、P2X受容体は興奮性受容体で消化管あるいは血管平滑筋の収縮に関与する。また、P2Y受容体は抑制性受容体であり消化管や血管平滑筋(内皮細胞依存性)の弛緩を引き起こすことが知られている。しかし、腎臓におけるATPの生理学および薬理学的な研究は糸球体由来のmesangial cellでのprostaglandin E2の産生、皮質sliceでのinositol trisphosphateの産生、上皮細胞での[Ca2+]iの変化、近位尿細管由来上皮細胞での[Ca2+]iの変化等が報告されているが、腎臓の構成単位である単一ネフロンを用いた系統的な研究はない。本研究ではラット単一ネフロン内P2受容体の分布と性質を明らかにするためにATPによる細胞内遊離カルシウム濃度([Ca2+]i)の変化、腎作用ペプチドホルモンとの関連及び糖新生への作用を解析した。
[結果および考察] 単離したネフロン分節での10-5MのATPによる細胞内遊離カルシウム濃度([Ca2+]i)の変化を調べた結果、糸球体(Glm;146.8±11.9%)、近位曲尿細管起始部(S1;139.0±9.0%)、皮質部集合尿細管(CCT;150.1±10.2%)および髄質部外層集合尿細管(OMCT;274.7±16.0%)で有意な[Ca2+]i上昇が認められた(図1)。しかし、近位尿細管直部、髄質部および皮質部太いヘンレの係蹄上行脚、遠位曲尿細管ではATPによる[Ca2+]i上昇は見られなかった。ATPによる[Ca2+]i上昇は用量依存的であり、そのEC50値はS1で1.1×10-5M、OMCTで4×10-6Mであった。この結果はS1およびOMCTに分布している受容体のATPに対する親和性が異なることを示している。ATPによる[Ca2+]i上昇は5-15秒でpeakに達した後90-120秒以内にbasal levelに近づきplateauに達した。OMCTでの[Ca2+]i上昇はtransient phaseとsustained phaseを持つ二相性であり、sustainedphaseは20分以上維持された。
ATPによる[Ca2+]i上昇のカルシウムの由来部位を明らかにするために1mMのEGTAを前処理し細胞外液のCa2+濃度を0にした後でもATPによりtransientな上昇は見られたが、sustained phaseは完全に抑制された。細胞膜に存在しカルシウムの出入りを調節するカルシウムchannel blockerのnifedipineと、細胞内カルシウムpoolからの放出抑制薬であるBAPTAの作用を調べた結果、nifedipine(10-6M)の5分間前処理によりsustained phaseが抑制された。また、30分間のBAPTA(5×10-5M)前処理によりtransient phaseが完全に抑制されることより、ATPによる[Ca2+]i上昇は主に細胞内カルシウムpoolからの放出であり、そのsustained phaseはCa2+ channelを介したものであると考えられた。多くの研究でATPによる[Ca2+]i上昇にはphospholipase Cが関与していることが報告されている。単離尿細管分節でのphospholipase Cの関与を検討するためphospholipase C拮抗薬であるpropranololを用いて[Ca2+]i上昇を調べた。その結果、10-4Mのpropranololを5分間前処理することでATPによる[Ca2+]i上昇が有意に抑制された。
次にATPに反応する受容体の種類を明らかにするためにS1とOMCTを用いてATP,ADP,AMPおよびadenosineによる[Ca2+]i上昇を測定した。その結果ATPとADPによる[Ca2+]i上昇は用量依存的な増加を示したが、AMPおよびadenosineによる[Ca2+]i上昇は認められなかった。この結果からS1およびOMCTに分布している受容体はP2であることが示唆され、そのsubtypeを確かめるため ,
, -methylene ATP(
-methylene ATP( ,
, -Me-ATP;P2X受容体selective agonist)、2-methylthio ATP(2-MeS-ATP;P2Y受容体selective agonist)およびUTPによる[Ca2+]i上昇を測定した。両セグメントの受容体に対するnucleotidesの親和性は2-MeS-ATP>ATP
-Me-ATP;P2X受容体selective agonist)、2-methylthio ATP(2-MeS-ATP;P2Y受容体selective agonist)およびUTPによる[Ca2+]i上昇を測定した。両セグメントの受容体に対するnucleotidesの親和性は2-MeS-ATP>ATP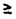 ADP>UTPであり、OMCTでのEC50値はATP:4×10-6M、ADP:5×10-6M、UTP:1.5×10-5M、2-MeS-ATP:6.2×10-7Mであった。
ADP>UTPであり、OMCTでのEC50値はATP:4×10-6M、ADP:5×10-6M、UTP:1.5×10-5M、2-MeS-ATP:6.2×10-7Mであった。 ,
, -Me-ATPによる[Ca2+]i上昇は10-3Mのみで見られた。P2XおよびP2Y受容体はATPとそのアナログの親和性の差で分けられる。P2X受容体に対する親和性の強度は
-Me-ATPによる[Ca2+]i上昇は10-3Mのみで見られた。P2XおよびP2Y受容体はATPとそのアナログの親和性の差で分けられる。P2X受容体に対する親和性の強度は ,
, -Me-ATP>ATP>2-MeS-ATPであり、P2Y受容体に対する親和性は2-MeS-ATP>ATP>
-Me-ATP>ATP>2-MeS-ATPであり、P2Y受容体に対する親和性は2-MeS-ATP>ATP> ,
, -Me-ATPであることより分類される。以上の結果よりネフロンに分布する受容体はP2Yと推定された。薬理学的にこれを確認するために比較的P2Y受容体に選択性を持つ拮抗薬として知られているsuraminおよびreactive blue 2の作用を検討した。suraminおよびreactive blue 2の2分間前処理によりATPによる[Ca2+]i上昇は用量依存的に抑制された。positive controlとして近位尿細管および集合尿細管に作用を示すangiotensin IIに対するsuraminおよびreactive blue 2の影響は認められなかった。suraminおよびreactive blue 2はnucleotide受容体であるP2Uに拮抗しないことが知られており、これらの結果からもS1およびOMCTに分布している受容体はP2Yであることが示唆された。
-Me-ATPであることより分類される。以上の結果よりネフロンに分布する受容体はP2Yと推定された。薬理学的にこれを確認するために比較的P2Y受容体に選択性を持つ拮抗薬として知られているsuraminおよびreactive blue 2の作用を検討した。suraminおよびreactive blue 2の2分間前処理によりATPによる[Ca2+]i上昇は用量依存的に抑制された。positive controlとして近位尿細管および集合尿細管に作用を示すangiotensin IIに対するsuraminおよびreactive blue 2の影響は認められなかった。suraminおよびreactive blue 2はnucleotide受容体であるP2Uに拮抗しないことが知られており、これらの結果からもS1およびOMCTに分布している受容体はP2Yであることが示唆された。
単離S1およびOMCTでのATPおよびUTP(10-4M)による[Ca2+]i上昇は同一濃度のATP,ADP,UTP,2-MeS-ATPの前処理によりほぼ完全に抑制された。この結果からこれらのnucleotidesは同一受容体と結合することが示唆された。内因性ペプチドホルモン受容体との関連性をみる目的で、ATPと血管作動性ホルモンとのdesensitizationを調べた。OMCTを用いて、ほぼ最大用量である10-6Mのvasopressin,angiotensin II,endothelin Iおよびbradykininをそれぞれ単独に適用すると[Ca2+]i上昇がその都度認められた。これらの血管作動性ホルモンの前処理後にATP(10-4M)を与えると、ATPによる[Ca2+]i上昇はATP単独投与と同様に認められたが、ATPを最初に適用した後血管作動性ホルモンを与えると、ホルモンによる[Ca2+]i上昇はほぼ完全に抑制された。この結果から、用いた血管作動性ホルモンとATPはそれぞれ異なる受容体に作用することが明らかにされた。しかしATPによる強力な細胞内[Ca2+]i動員の有無は血管作動性ホルモンの作用に影響を及ぼすことが示唆された(表1)。即ちペプチドホルモンの腎作用は細胞外ATPにより調節される可能性がはじめて提示された。
他方、ATPは神経刺激による放出に加え、細胞が障害を受けた時も細胞外に遊離される。生体は障害を克服するための適応現象の一つとしてグルコースの新生亢進を通した細胞の代謝改善を生来する。腎臓は肝とともに諸種基質から糖を新生する臓器である。ネフロン内糖新生能は近位尿細管のみ限局しているので皮質tubulc suspensionを用いて糖新生に対するATPの作用を調べた。10-4M ATPはpyruvate(2.5mM)からの糖新生を約50%増加させた。このATPによる糖新生上昇はsuramin(10-4M)により抑制されたことよりATPによる糖新生の促進はP2Y受容体を介したものであることが示唆された(図2)。
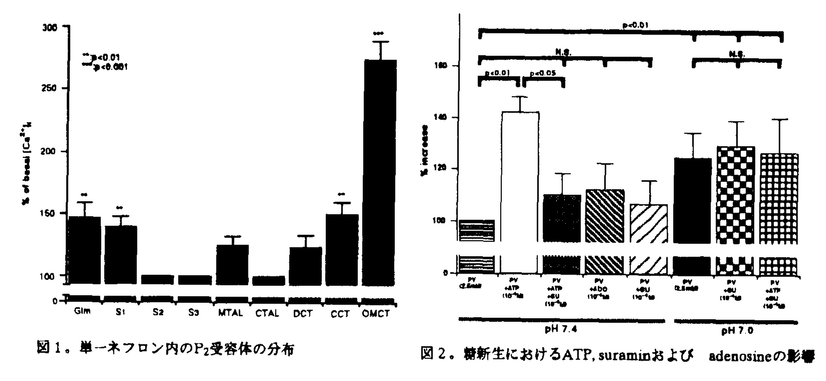 図表図1。単一ネフロン内のP2受容体の分布 / 図2。糖新生におけるATP,suraminおよびadenosineの影響
図表図1。単一ネフロン内のP2受容体の分布 / 図2。糖新生におけるATP,suraminおよびadenosineの影響 表1。細胞内遊離カルシウム上昇におけるATPおよび血管作動性ホルモンの相互作用
表1。細胞内遊離カルシウム上昇におけるATPおよび血管作動性ホルモンの相互作用