チロシン燐酸化酵素はリセプター型と非リセプター型に大別される。リセプター型酵素はその細胞外の領域でリガンドと結合し、細胞質側の触媒領域の活性化により細胞内にシグナルを伝達する。一方、非レセプター型チロシン燐酸化酵素(NR-PTK)は、細胞質に存在する酵素で、多くは細胞表面蛋白と接して、細胞表面からのシグナルを細胞内に伝達する手助けをしていることが明らかとなってきた。NR-PTKはさらにいくつかのグループに分けられるが、これらの全ては、細胞の増殖、分化、そして分化後の細胞機能を修飾するいくつかのタイプのシグナル伝達に関与していると考えられ、また、これらの多くが、癌化能を有することが示されている。 NR-PTKに属するFAK(Focal Adhesion Kinase)は、v-srcでトランスフォームしたニワトリ細胞中のチロシン燐酸化蛋白を認識するモノクローナル抗体の一つに反応する125kDのタンパク質として同定された(Kanner、S.B.et al.1990)。ニワトリFAKcDNAはこのモノクローナル抗体2A7を用いて、発現ライブラリーより単離された。これとは別にマウスFAKはチロシン燐酸化酵素で保存されている配列のプライマーを用いたRT-PCRにより、Hanks等のグループ(Hanks,S.K.et al.1992;Devor,B.B.et al.1993)と我々のグループの藤本によりクローニングされた。また、ヒトFAK cDNAも同様の方法によりクローニングされた(Andre,E.& Becker-Andre,M.1993)。これらは推定されるアミノ酸配列で95%と高い相同性を示している。FAKはSH2,SH3領域、ミリスチレーション部位を持たず、他のNR-PTKと有意な相同性を示さないことから非常に興味深い分子であると考えられた。 FAKは今まで調べられている殆ど全ての細胞株・組織で発現しており(Hanks,S.K.et al.1992;Andre,E.& Becker-Andre,M.1993;Turner,C.E.et al.1993)、培養細胞ではFAK蛋白はfocal adhesionに局在していることが知られている。FAKはv-srcなどのNR-PTK癌遺伝子による癌化には関与しているが、ras等の他の癌遣伝子による癌化には関与していないことが示されている(Guan,J.-L.& Shalloway,D.1992;Weiner,T.M.et al.1993)。またボンベシン、バソプレッシン、エンドセリンによる細胞刺激によりFAKが燐酸化されることから、分裂促進的ニューロペプチドによるシグナル伝達への間与も示唆されている。しかしながら、最も與味深いのはインテグリンからもたらされる細胞内へのシグナル伝達機構に於けるFAKの機能である(Lipfert,I.et al.1992)。 インテグリンは細胞外のリガンドとの結合領域、細胞膜貫通領域、細胞質領域からなり、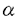 鎖と 鎖と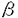 鎖のヘテロ二量体として細胞表面リセプターを形成している一群である。 鎖のヘテロ二量体として細胞表面リセプターを形成している一群である。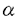 鎖と 鎖と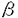 鎖の組み合わせの種類によってフィブロネクチン、ラミニン、コラーゲンのような細胞外マトリックス(ECM)タンパク質との結合特異性が決まっている。一般に、一つのインテグリンはいくつかのECM蛋白を認識し、またあるECM蛋白はいくつかのインテグリンによって認識されると考えられている(Hynes,R.O.1992)。インテグリンを介したシグナル伝達機構の一説によると、インテグリンを介したシグナルは細胞骨格の形成に関与していると考えられている。インテグリンを介したECMと細胞との接着部位であると考えられるfocal adhesionは細胞骨格の会合のための核(nucleation foci)として働いている。FAKの局在、そしておよびいくつかの観察から(Lipfert,L.et al. 1992;Schaller,M.D.et al.1992;Hanks,S.K.et.al.1992)、インテグリンの二量体形成とFAKの活性化との間の強い関連性が示唆されている。また、FAKはsrcファミリーの基質である(Kanner,S.B.1990;Guan,J.-L.& Shalloway,D.1992;Cobb,B.S.et al.1994)ことが知られており、srcとFAKの相互作用がインテグリンからのシグナル伝達に関係していると推測される。しかしながら、この可能性を支持する明らかな証拠はまだ得られていない。 鎖の組み合わせの種類によってフィブロネクチン、ラミニン、コラーゲンのような細胞外マトリックス(ECM)タンパク質との結合特異性が決まっている。一般に、一つのインテグリンはいくつかのECM蛋白を認識し、またあるECM蛋白はいくつかのインテグリンによって認識されると考えられている(Hynes,R.O.1992)。インテグリンを介したシグナル伝達機構の一説によると、インテグリンを介したシグナルは細胞骨格の形成に関与していると考えられている。インテグリンを介したECMと細胞との接着部位であると考えられるfocal adhesionは細胞骨格の会合のための核(nucleation foci)として働いている。FAKの局在、そしておよびいくつかの観察から(Lipfert,L.et al. 1992;Schaller,M.D.et al.1992;Hanks,S.K.et.al.1992)、インテグリンの二量体形成とFAKの活性化との間の強い関連性が示唆されている。また、FAKはsrcファミリーの基質である(Kanner,S.B.1990;Guan,J.-L.& Shalloway,D.1992;Cobb,B.S.et al.1994)ことが知られており、srcとFAKの相互作用がインテグリンからのシグナル伝達に関係していると推測される。しかしながら、この可能性を支持する明らかな証拠はまだ得られていない。 この問題を明らかにするために、本研究ではまず遺伝子相同組換えを用いてFAK遺伝子の燐酸化領域を欠いたマウスES細胞を樹立した(Fig.1,2)。更にFAKが直接細胞の増殖や分化に関係しているかどうかを調べるため相同染色体両方のFAK遺伝子の燐酸化領域を不活化したES細胞株を樹立した(Fig.3)。FAK遺伝子が不活化していることはRT-PCRとウェスタンブロッテイングにより確かめた(Fig.4)。 次にFAK遺伝子を不活化したES細胞を用いてその分化能力をin vitroおよびin vivoの分化系で検討した。in vitroの分化系を用いた解析では野生型、FAK不活性の両ES細胞株は赤血球系譜の細胞に分化できた(Fig.5)。また、これらのES細胞をヌードマウスの皮下移植により生じたテラトーマ内には三胚葉由来の細胞、組織が観察され(Fig.6)、細胞の分化能には明らかな差異は認められなかった。しかしながら、胚発生においては、FAK遺伝子欠損により中胚葉の異常のために8日胚以降の胚発生が進まないことが観察された(Fig.9,10)。頭部間葉、傍軸中胚葉や、羊膜、卵黄嚢、脈管構造などの組織はgastrulation初期では正常に形成されているよう観察されるが、以降これらの組織には正常胚に比べ著しい発達の阻害が観察される。更に、FAK欠損胚の表現型はフィブロネクチン欠損胚と非常によく似ており、このことはフィブロネクチンからのシグナルがFAKを介して細胞内に伝えられることを強く示唆している。個体発生に於けるFAK欠損の影響をまとめると、その異常は特に中胚葉系の細胞の接着性、移動、または増殖の異常によると推測され、組織構築をまとめる能力を欠いたことによると考えられる。 8日目のFAK欠損胚からの初代培養纎維芽細胞では培養容器への付着性、細胞の広がりに於いては正常胚由来のものと差がみられなかったが、ストレスファイバーの形成不全が認められた(Fig.11)。このことは、FAKがECMから細胞骨格へのシグナル伝達に関係していることを示している。 ECMからのインテグリン、FAKを介するシグナル伝違の分子機構はまだ殆ど解っていない。最近、in vitroの実験よりFAKの基質となるfocal adhesionタンパク質、パキシリンが同定された(Cobb,B.S.et al.1994;Turner,C.E.& Miller,J.T.1994)。そこで、バキシリンの燐酸化を調べた結果、FAKを不活化したES細胞でのバキシリンの燐酸化が明らかに減少していることがわかった。 しかしながら,パキシリンの燐酸化はFAK欠損細胞中でも完全になくなるわけではなく、このことからパキシリンの燐酸化に関しては、FAKの機能を相補する他の燐酸化酵素の存在、またはFAKを介さないシグナル伝達経路の存在の可能性が示唆される。しかし,もしFAKの機能を相補するような燐酸化酵素があるならば、FAK遺伝子欠損胚の表現型はフィブロネクチン欠損胚の表現型より弱く現れることが予想されるが、本研究の結果ではFAK欠損胚の表現型はフィブロネクチン欠損胚より弱く現れていることはなく、このことから、パキシリンの燐酸化に関してはFAKを介さずにパキシリンを燐酸化する他の経路が存在している可能性の方が高いと考えられる。その候補としては現在のところsrcファミリーのチロシン燐酸化酵素が有力であると思われる(weng,Z.et al.1993;Cobb,B.S.et al.1994;Schaller,M.D.et al.1994)。それらも含めて、どの様な燐酸化酵素によってパキシリンが燐酸化されるのか、またこの様な燐酸化がどの様な細胞機能に結びつくのか、問題として残っており、さらなる解析が必要である。 |