本研究は妊娠を維持するプロゲステロン(Pg)により誘導される免疫抑制機構が習慣流産(RSA)免疫療法に重要な役割を果たしているとの仮説のもとに、Pgにより誘導される免疫抑制因子(PISF)の特性及びこの因子のRSA免疫療法における臨床的意義を解明するものであり、下記の結果を得ている。 1.我々はまず非妊婦のリンパ球混合培養(MLR)の系に0.1-10.0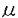 g/ml濃度のPgを加えて、5日間培養してから、培養上清を回収した。この培養上清にPg誘導される免疫抑制因子が存在するかどうかを確認するため、アロのMLR反応に対する抑制効果を検討した。0.1-1.0 g/ml濃度のPgを加えて、5日間培養してから、培養上清を回収した。この培養上清にPg誘導される免疫抑制因子が存在するかどうかを確認するため、アロのMLR反応に対する抑制効果を検討した。0.1-1.0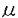 g/ml濃度のPgからの培養上清はアロのMLRの反応を抑制することが認められたが、2.0 g/ml濃度のPgからの培養上清はアロのMLRの反応を抑制することが認められたが、2.0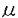 g/ml以上濃度のPgでは抑制が認められなかった。0.1-1.0 g/ml以上濃度のPgでは抑制が認められなかった。0.1-1.0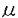 g/ml濃度のPgは直接MLR反応を抑制し、培養上清の中ではPgと違う抑制物質であるPISFが存在することが証明された。妊婦末梢血中のPg濃度は0.02-0.2 g/ml濃度のPgは直接MLR反応を抑制し、培養上清の中ではPgと違う抑制物質であるPISFが存在することが証明された。妊婦末梢血中のPg濃度は0.02-0.2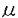 g/mlであることを考え、以下の実験では0.1 g/mlであることを考え、以下の実験では0.1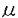 g/mlのPg濃度でPISFを調製した。 g/mlのPg濃度でPISFを調製した。 2.PISFの産生がPgに依存性があるかどうかを確認するため、PgRのアンタゴニストであるRu486を添加して作った培養上清の存在下で同様のMLR反応を行なった。その結果、1.0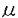 g/ml Ru486を添加すると、Pgによる抑制作用は消失した。 g/ml Ru486を添加すると、Pgによる抑制作用は消失した。 3.PISFの産生細胞を調べるため、免疫磁気ビーズを用いてCD4、CD8、CD14細胞をそれぞれ除いた細胞群により調製されたPISFのMLR反応抑制効果について検討した。その結果、CD4細胞が存在しない場合でもPISFの抑制作用は見られたが、CD8とCD14細胞が存在しないと、PISFの抑制作用が見られなかった。従って、PISFの産生はCD8とCD14陽性細胞に関連すると考えられた。 4.PISFの分子量を調べるため、限外濾過膜を使ってPISFを10万以上、10万と3万の間、3万以下にカットしたところ、10万以上の分画ではPISFの抑制作用が認められたが、10万以下の分画ではPISFの抑制作用が認められなかった。従って、PISFの分子量は10万w.m以上と推定された。 5.二重蛍光抗体法によりヒト末梢血単核球のPgR陽性細胞のサブゼットを調べた。CD3、CD8、及びCD14陽性細胞では、PgRの発現が強く、CD4陽性細胞では、PgRの発現が弱く、CD16陽性細胞では、PgRが発現していないことが判明した。 6.非妊婦、妊婦、RSA患者免疫療法前後単核球をそれぞれ0-10.0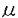 g/ml濃度のPgで3時間培養することによりPgRの発現を検討した。Pgが存在しないとRSA患者免疫療法前単核球のPgRの発現は非妊婦、妊婦と比べると低かった。免疫療法後では免疫療法前と比べると増加する傾向が見られたが、有意差には至らなかった。免疫療法前にはPgにより誘導されるPgRの発現は高くなかったが、免疫療法後のPgRの発現は有意に高くなった。従って、RSA患者ではPgRの発現機構に異常が存在することが推定され、PgRの発現の状態を調べることによって免疫療法の効果を判断できる可能性が示唆された。 g/ml濃度のPgで3時間培養することによりPgRの発現を検討した。Pgが存在しないとRSA患者免疫療法前単核球のPgRの発現は非妊婦、妊婦と比べると低かった。免疫療法後では免疫療法前と比べると増加する傾向が見られたが、有意差には至らなかった。免疫療法前にはPgにより誘導されるPgRの発現は高くなかったが、免疫療法後のPgRの発現は有意に高くなった。従って、RSA患者ではPgRの発現機構に異常が存在することが推定され、PgRの発現の状態を調べることによって免疫療法の効果を判断できる可能性が示唆された。 7.免疫療法によって、RSA患者単核球がPISFを産生するようになるかどうか調べた。免疫療法後生児を得た6人(成功例)と得られなかった2人(失敗例)の単核球を用いて、免疫療法前後における単核球により産生されるPISF活性を比較した。成功例6人すべてにおいて免疫療法前と比べると、免疫療法後PISFの活性が高くなった。失敗例患者の単核球では免疫療法による、PISFの活性の増加は認められなかった。従って、PISFの産生能とRSA免疫療法の成否との関連が示された。 以上、本論文では、Pgにより誘導される免疫抑制因子の存在及び特性を明らかにし、抑制因子の産生能と免疫療法の予後との関連を見い出した。本研究は正常妊娠維持機構及びRSAにおける免疫療法のメカニカズムの解明に重要な貢献をなすと考えられ、学位の授与に値するものと思われる。 |