顆粒球・マクロファージコロニー刺激因子(Granulocyte-Macrophage Colony-stimulating Factor,GM-CSF)は顆粒球、単球系の造血前駆細胞に作用し増殖や分化を誘導するのみならず、成熟細胞においてはその機能亢進を刺激することが知られている造血因子の一つである。ヒトGM-CSFがその作用を発現するには標的細胞上に発現した特異的受容体との結合が必須である。ヒトGM-CSFに対する受容体は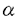 鎖及び 鎖及び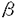 鎖の二種類のサブユニットから構成されている。 鎖の二種類のサブユニットから構成されている。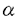 鎖をコードするcDNAは1989年にGearingらのグループによってクローニングされた。 鎖をコードするcDNAは1989年にGearingらのグループによってクローニングされた。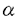 鎖は単独でヒトGM-CSFに対し低親和性の特異的結合能を有している。一方、 鎖は単独でヒトGM-CSFに対し低親和性の特異的結合能を有している。一方、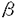 鎖をコードするcDNAは1990年にHayashidaらによってクローニングされた。興味深いことに 鎖をコードするcDNAは1990年にHayashidaらによってクローニングされた。興味深いことに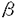 鎖は単独ではいかなる造血因子とも結合能を有しないが、ヒトGM-CSF,インターロイキン3(Interleukin-3,IL-3)及び5(IL-5)においては各々のリガンド対して特異的結合能を有する 鎖は単独ではいかなる造血因子とも結合能を有しないが、ヒトGM-CSF,インターロイキン3(Interleukin-3,IL-3)及び5(IL-5)においては各々のリガンド対して特異的結合能を有する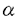 鎖との共発現でそれぞれ高親和性ヒトGM-CSF,IL-3,IL-5受容体を構成する分子となる。 鎖との共発現でそれぞれ高親和性ヒトGM-CSF,IL-3,IL-5受容体を構成する分子となる。 受容体の機能やそれに続く細胞内の情報伝達機構を解析する方法の一つとして、受容体の再構成がある。この方法は、受容体分子のアミノ酸配列をコードするcDNAを発現ベクターに組み込み、これを目的の細胞に導入することによって人工的に細胞表面に受容体を発現させる方法である。この方法によって目的の受容体の発現量を高めたり、本来発現のない細胞において受容体を発現させることが可能となる。これまでにも、ヒトGM-CSF受容体に関して受容体の再構成実験が主にマウスの血液系細胞株を用いて行われてきた。これらの実験結果によると、受容体分子の再構成のみによってその細胞株はヒトGM-CSF刺激に応じて増殖の亢進が認められた。即ち、上記の受容体は再構成された細胞において増殖刺激を伝達しうることが判明したわけである。しかし、非造血器系細胞を用いた受容体の再構成の実験はこれまで詳しくは行われていなかった。そこで私は、マウスの線維芽細胞であるNIH3T3細胞を用いてヒトGM-CSF受容体の再構成実験を以下の方法で行い成果を得た。 発現ベクターに組み込んだヒトGM-CSF受容体の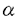 鎖と 鎖と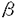 鎖をコードするcDNAをネオマイシン耐性遺伝子を組み込んだ発現ベクターと共にNIH3T3細胞にリポフェクチン法によって遺伝子導入を行った。ネオマイシンに対して耐性を獲得したNIH3T3細胞を限界希釈法によってクローン化した後、細胞表面上の受容体分子の発現を放射性ヨード標識したリコンビナントヒトGM-CSFを用いた化学的架橋法によって解析した。解析の結果、 鎖をコードするcDNAをネオマイシン耐性遺伝子を組み込んだ発現ベクターと共にNIH3T3細胞にリポフェクチン法によって遺伝子導入を行った。ネオマイシンに対して耐性を獲得したNIH3T3細胞を限界希釈法によってクローン化した後、細胞表面上の受容体分子の発現を放射性ヨード標識したリコンビナントヒトGM-CSFを用いた化学的架橋法によって解析した。解析の結果、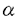 16細胞においては95kDaの、 16細胞においては95kDaの、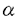 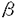 15細胞においては95kDa及び150kDaの放射活性を持った複合体が得られた。これらの複合体の分子量はそれぞれヒトGM-CSFと受容体の 15細胞においては95kDa及び150kDaの放射活性を持った複合体が得られた。これらの複合体の分子量はそれぞれヒトGM-CSFと受容体の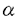 鎖、 鎖、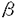 鎖の分子量の和とほぼ一致した。また、これらの結合は非標識ヒトGM-CSF存在下で阻害を受けることからGM-CSFに特異的なものであることが明らかとなった。これらの細胞を用いてScatchard解析を行いヒトGM-CSFに対する親和性を解析したところ 鎖の分子量の和とほぼ一致した。また、これらの結合は非標識ヒトGM-CSF存在下で阻害を受けることからGM-CSFに特異的なものであることが明らかとなった。これらの細胞を用いてScatchard解析を行いヒトGM-CSFに対する親和性を解析したところ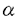 16細胞においては一相性の直線が得られ、解離定数(Kd)は5.5nMであった。一方、 16細胞においては一相性の直線が得られ、解離定数(Kd)は5.5nMであった。一方、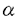 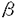 15細胞においては二相性の曲線が得られ解離定数(Kd)が1.3nM及び30pMの二つの親和性を示すことが明らかとなった。以上の験結果よりNIH3T3細胞上に低親和性及び高親和性ヒトGM-CSF受容体が再構成されたと考え、これらの細胞を用いて更に解析を行った。 15細胞においては二相性の曲線が得られ解離定数(Kd)が1.3nM及び30pMの二つの親和性を示すことが明らかとなった。以上の験結果よりNIH3T3細胞上に低親和性及び高親和性ヒトGM-CSF受容体が再構成されたと考え、これらの細胞を用いて更に解析を行った。 細胞内蛋白質のチロシン残基のリン酸化は細胞内の情報伝達において重要な生化学的変化であることが知られている。実際にGM-CSF受容体を内因性に発現した細胞をGM-CSFで刺激すると幾つかの細胞内蛋白質が誘導的にチロシンリン酸化を受ける報告が数多く知られている。以上を背景に、細胞内蛋白質のチロシンリン酸化がヒトGM-CSF受容体を再構成したNIH3T3細胞において起こるか否かを抗リン酸化チロシン抗体を用いたウエスタンブロット法によって解析した。解析の結果、高親和性ヒトGM-CSF受容体を発現したNIH3T3細胞においてはヒトGM-CSF刺激によって受容体の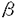 鎖及び分子量40-45kDaの蛋白質が誘導的にチロシンリン酸化を受けることが判明した。ヒトGM-CSF受容体に関しては 鎖及び分子量40-45kDaの蛋白質が誘導的にチロシンリン酸化を受けることが判明した。ヒトGM-CSF受容体に関しては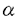 鎖、 鎖、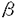 鎖共に内因性のチロシンキナーゼ活性は認められない。よって、この実験結果からNIH3T3細胞に内因性のチロシンキナーゼが活性化されたことが間接的に証明された。 鎖共に内因性のチロシンキナーゼ活性は認められない。よって、この実験結果からNIH3T3細胞に内因性のチロシンキナーゼが活性化されたことが間接的に証明された。 ところで、GM-CSFが標的細胞に対して発揮する作用は1,増殖刺激2,分化誘導3,機能亢進に分類することができる。これらのうち増殖刺激に関してDNA合成の角度から解析を行った。解析にはトリチウム標識したチミヂンの取込みを測定する方法を用いた。解析の結果、高親和性ヒトGM-CSF受容体を細胞表面上に発現した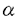 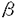 15細胞においては、ヒトGM-CSF刺激によってチミヂンの取込みの有意な亢進が認められた。この結果から、 15細胞においては、ヒトGM-CSF刺激によってチミヂンの取込みの有意な亢進が認められた。この結果から、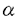 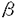 15細胞においてはDNAの合成が誘導されることが明らかとなった。親株のNIH3T3細胞及び低親和性ヒトGM-CSF受容体を発現した 15細胞においてはDNAの合成が誘導されることが明らかとなった。親株のNIH3T3細胞及び低親和性ヒトGM-CSF受容体を発現した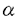 16細胞においてはこのような現象は観察されなかった。また、高親和性受容体を発現した 16細胞においてはこのような現象は観察されなかった。また、高親和性受容体を発現した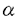 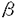 15細胞をヒトGM-CSF存在下で培養を行ったところ、非存在下で培養を行った 15細胞をヒトGM-CSF存在下で培養を行ったところ、非存在下で培養を行った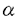 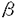 15細胞と比較して細胞の形態に明らかな差が認められた。しかも一度形態学的に変化した 15細胞と比較して細胞の形態に明らかな差が認められた。しかも一度形態学的に変化した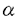 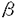 15細胞を引き続きヒトGM-CSF非存在下で培養を行ったところ形態の変化は元に復帰した。即ち、ヒトGM-CSFに特異的でかつ可逆的な形態変化を起すことも明らかとなった。 15細胞を引き続きヒトGM-CSF非存在下で培養を行ったところ形態の変化は元に復帰した。即ち、ヒトGM-CSFに特異的でかつ可逆的な形態変化を起すことも明らかとなった。 以上私が行った研究結果をまとめると、高親和性ヒトGM-CSF受容体を発現したNIH3T3細胞においては、ヒトGM-CSF刺激によって多くの生化学的、生物学的変化が観察された。生物学的変化に関しては、ヒトGM-CSF刺激によってDNA合成の亢進及び可逆的な細胞の形態変化が引き起こされることが明らかとなった。一方、生化学的変化に関しては、細胞に再構成したヒトGM-CSF受容体の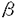 鎖及び未知の分子量40-45kDaの細胞内蛋白質がヒトGM-CSF刺激によって誘導的チロシンリン酸化を受けることが明らかとなり、NIH3T3細胞に内因性に発現したチロシンキナーゼが活性化されたことが間接的に証明された。それと同時にこのリン酸化反応が前述のDNA合成の亢進や可逆的な細胞の形態変化を引き起こす細胞内の情報伝達に関与している可能性も示唆された。 鎖及び未知の分子量40-45kDaの細胞内蛋白質がヒトGM-CSF刺激によって誘導的チロシンリン酸化を受けることが明らかとなり、NIH3T3細胞に内因性に発現したチロシンキナーゼが活性化されたことが間接的に証明された。それと同時にこのリン酸化反応が前述のDNA合成の亢進や可逆的な細胞の形態変化を引き起こす細胞内の情報伝達に関与している可能性も示唆された。 造血因子であるヒトGM-CSFに関して、その受容体分子のみの再構成によって細胞内の蛋白質のチロシンリン酸化、DNA合成、細胞の形態変化がヒトGM-CSF刺激によって非造血器系細胞である線維芽細胞において引き起こされた事実はヒトGM-CSF受容体の広汎な機能を裏付けるものとして貴重なものと言える。 |