| (緒言) 最近の癌治療の成果は目覚ましいものがあり、5年生存率も急激に高くなってきている。しかしながら、従来の外科的切除、放射線治療そして化学療法をもってしても、二次的に波及した癌あるいは進行転移癌に対する治療法は、未だ満足すべきものではない。それを補い、しかもより非侵襲的な治療法が考慮されるべきである。 植物あるいは動物の毒素(トキシン)と癌の特異抗原に対する抗体を結合して癌細胞をターゲティングするミサイル療法の基本的な概念は既に十数年前から存在し、一時は非常に期待のもたれた方法であったが、当時まだ毒素自体の性質がはっきりとしていなかったために、研究の進展は困難であった。毒素のX線解析やDNA解析により、遺伝子組換えを用いて毒素を精製できるようになったのと、毒素の機能が一つずつ明らかになったことで、改めてこの治療法への期待が膨らみはじめた。 我が国では、この治療法自体があまり知られていないのが現状であるが、米国国立癌研究所では既に臨床治験第一段階で、実際に患者に投与し好成績をおさめている。 本論文は、この毒素を用いて新しい抗体やリガンドを結合させたり、あるいは毒素自体の改良により、より好ましいイムノトキシンを作成し、実際に動物実験の段階まで研究した成果を報告するものである。 Pseudomonas exotoxin(以下PE)は、緑膿菌の出すエクソトキシンの一つであり、66kDaの分子量を持つ。1986年にAlluredらのX線解析により3つのメジャードメインと一つのマイナードメインからなっていることが明らかになった。その後、cDNAがクローニングされて、部分欠失や点突然変異の導入実験により受容体の結合部位であるドメインIa、トランスロケーション機能を持つドメインII、ADPリボシル化の機能を持つドメインIIIの役割が明らかになった。マイナードメインであるIbは長い間その機能が不明であったが、今回行った部分欠失実験によりドメインIIとドメインIIIの機能が正しく発揮されるように両ドメインをつなぐ橋渡し、いわゆるリンカー様の機能があることが判明した。 第1章では、グリコシレーションを受ける可能性がある416番目のアミノ酸の置換により、ADPリボシル化能を失わず、in vivoにてLD50が10倍にも上がったという結果を報告する。第2章では、あるイムノトキシンにはドメインIIがなくてもcytosolにトランスロケートし、毒素の機能を果たしうるという興味深い結果を報告する。最終章にて、2年前に発見されたErbBファミリー受容体のリガンドであるHeregulin(HRG)を使った新しいイムノトキシンを精製し、このトキシンが乳癌や胃癌に極めて有効であるという報告と共にTGF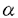 やHRGなどのリガンドトキシンや抗体を結合させた抗体トキシンとの細胞内輸送の経路の違いにも触れる。 やHRGなどのリガンドトキシンや抗体を結合させた抗体トキシンとの細胞内輸送の経路の違いにも触れる。 (実験方法) リコンビナントトキシンの精製にはT7プロモーターを含むベクターのなかに抗体又はリガンドと共に毒素の一部のDNA配列を組み込んでT7RNAポリメラーゼ遺伝子を含む大腸菌株であるBL21にトランスフェクトした。またこの菌株はlacZによる制御能も持つことから、IPTGにより蛋白発現を誘導することができた。発現蛋白は変性、再生後に、3種のカラム(イオン交換カラムとサイジングカラム)を通すことによって、95%以上の純度を持つ分子がえられた。部分欠失や点突然変異の挿入はKunkel法あるいはPCR法を利用し、その変異はDNAの塩基配列を確認することで決定した。抗腫瘍実験は、1サンプルについて少なくとも5匹以上のヌードマウスを用い、腫瘍細胞の発育度により移植する数を決めてこれを皮下に注射した。腫瘍の大きさが50mm3になったところで、治療を開始した。コントロール群には溶媒のみ(PBS+0.2%HSA)を投与した。治療群は、そのイムノトキシンの性質により、隔日3回の静注又は、ポンプによる7日間連続の腹腔内投与のいずれかを選択した。 (結果) 第1章ではErbB2に対する抗体であるe23とPE38又はPE38KDELを結合させた抗体トキシンを用いてKDEL配列とREDLK配列(本来PEのもつC末端の配列)との様々な違いを述べる。IC50においてはKDELをもった分子の方が10倍近く毒性が強かった。マウスにおけるにLD50おいては数倍以下の違いしかみられなかったが、抗腫瘍性は明らかにKDELをもった分子の方が強かった。また、ドメインIIIの416番目のアスパラギンをロイシンに置換させた分子はIC50において元の抗体トキシンと比して2-3倍の活性低下にも拘わらずLD50が10数倍高くなっていた。抗腫瘍性は同率のLD50ではほとんど差は認められなかった。 第2章ではIbとIIの部分欠失により、ドメインIbがIIとIIIの相互作用を保持するのに必要なリンカー様の機能をもつことを示した。ドメインIIの一定以上の欠失により、毒性はいったん低下したが、全欠失により却って毒性を復元するという興味深い結果を得た。また、ドメインIIIのみのイムノトキシンの抗腫瘍性は今までの分子(TP40)より10倍以上あがっていた。 第3章では、HRGのリガンドトキシンを用いてターゲットとする受容体を過剰発現している腫瘍細胞に対する細胞毒性を検討した。また、HRGの4つのアイソタイプそれぞれをつなげたトキシンを用いてそれらの分子間の違いを解析した。従来、HRG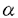 とHRG とHRG の機能の違いについては意見が一致していなかったが、今回の研究結果からはHRG の機能の違いについては意見が一致していなかったが、今回の研究結果からはHRG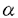 とHRG とHRG の間には、細胞毒性の差が100倍以上もあるという事実を始めとして、それぞれの分子の特徴をin vitroで明らかなデータにした。また、抗腫瘍作用の有無を調べたところ、同率のLD50ではHRG の間には、細胞毒性の差が100倍以上もあるという事実を始めとして、それぞれの分子の特徴をin vitroで明らかなデータにした。また、抗腫瘍作用の有無を調べたところ、同率のLD50ではHRG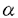 トキシンとHRG トキシンとHRG トキシンの明らかな差は見られなかったが、顕著な抗腫瘍作用は共に認められた。ただし、これもTGF トキシンの明らかな差は見られなかったが、顕著な抗腫瘍作用は共に認められた。ただし、これもTGF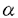 と同様に、抗体トキシンの様な完全な腫瘍退縮は認められず、投与終了後の再発育があった。 と同様に、抗体トキシンの様な完全な腫瘍退縮は認められず、投与終了後の再発育があった。 (考察) 抗体トキシンもリガンドトキシンも共に顕著な抗腫瘍作用をもつことは明らかであるが、これら2つのトキシンの間には、また様々の違いもあることが解かった。リガンド-受容体コンプレックスは、抗体-受容体コンプレックスとは違う細胞内輸送経路を持っているであろうという仮定が成り立つ。ADPリボシル化能しか持たないドメインIIIとだけ結合しその細胞毒性を保持できるのは、リガンドトキシンのみであり、今回データとしては示していないが、HRGとドメインIIIをつなげたものを作成した場合にも、in vitroでの細胞毒性は多くて2-3倍の減少を認めただけであった。一方、抗体トキシンでは結合親和力は正常でありながら細胞毒性を失った。リガンドトキシンで抗体トキシンの様な完全寛解が期待できないのは、トキシン投与終了後に、いったん縮小した腫瘍細胞が、生体内の正常な細胞から生成されたリガンドにより再発育するからであろう。しかし、投与量と期間と方法により、この問題は今後改善されうると思われる。なぜならば、静脈注射ではなく、ポンプによる持続的投与でTGF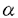 トキシンやHRGトキシンは、顕著な抗腫瘍作用を発揮したからである。 トキシンやHRGトキシンは、顕著な抗腫瘍作用を発揮したからである。 もちろん、イムノトキシンは今後なお改良を続ける必要がある。抗体トキシンではマウスのモノクローナル抗体を使っているため、抗マウス抗体の出現をおさえるために、抗体の一部をヒトのアミノ酸配列に置き換えるヒト-マウスのキメラ抗体の作成という研究もなされている。また、細胞毒性を保持したままでより小さな分子量を持つ物質をつくることは、腫瘍細胞や組織への深部透過性の向上と、PEに対する抗体形成を抑制するために不可欠である。この他に、サイクロスポリンやスパガリンなどの免疫抑制剤などと併用投与することで、マウスのモノクローナル抗体やPEに対する抗体の産生をおさえるという研究も行われている。 (結語) 他の毒素(リシン、ジフテリアトキシンなど)と比して副作用の少なさと、操作の簡便さ、また、既にPEの抗体を有するヒトの割合が未だ3%という事実から、イムノトキシンの今後の癌治療に果たす役割はますます大きくなるであろう。現在の外科的治療や放射線治療あるいは化学療法に抵抗性の腫瘍の新しい治療法の一つとして我が国でも近い将来、重要な地位を獲得することが期待される。 |