| I序 細胞に細胞外からの刺激が加わると、細胞膜に存在するリン脂質がホスフォリパーゼA2によって切り出され、アラキドン酸を細胞内外に放出する。このアラキドン酸は細胞内に存在する諸酵素によって様々な生理活性物質に変換される(アラキドン酸カスケード)。これらの物質は脂質であること、一つの物質が極めて低い濃度で多彩な生理活性を持っていること、しかもその生理活性の一部はアラキドン酸カスケードに属する物質間で重なっていることなどの特徴を持っている。アラキドン酸カスケードの形成に関与している酵素群に対しては、生合成酵素を中心にタンパク質化学的、あるいは遺伝子工学的な手法をもって精力的に研究が進められてきた。しかし、不活性化、分解系の酵素に対して我々の得られる情報は極めて少ない。本研究はアラキドン酸カスケードに属する物質の中でも、最も強い白血球の遊走反応を持ち、炎症反応に深く関与していると考えられているロイコトリエンB4(LTB4)の実質臓器における新しい代謝経路を解明し、その分解系の初発酵素であるLTB412-hydroxydehydrogenaseを精製し、cDNAのクローニングと大腸菌における発現を行ったものである。 II実験方法と結果 逆相のHPLC(高速液体クロマトグラフィー)を用いてLTB4から酵素的に代謝されるやや疎水性の物質を定量するシステムを開発し、ブタ、モルモットの各臓器における酵素活性を測定した。共に、腎臓に最も強い酵素活性が観察されたため、ブタの腎臓を材料に以下の実験を行った。LTB4が代謝されて順次生成する二つの物質を分取して、質量分析とNMR解析によってこれらが12-oxo-LTB4と10,11,14,15-tetrahydro-12-oxo-LTB4であることを決定した。ブタの腎臓の細胞質分画を材料にして、硫安分画、5種のカラムクロマトグラフィーによって、LTB4を12-oxo-LTB4に変換する酵素を単一標品にまで精製した。140gの腎臓の細胞質画分から精製された酵素タンパク質は約65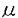 g、精製度は約10,000倍であった。本酵素はSDS-PAGE,ゲル濾過カラム上、共に約35kDaの分子量を示したため、単量体タンパク質であると考えられた。精製した酵素を用いて、酵素学的な解析を行ったところ、本酵素はLTB4の12(R)の構造を持つ水酸基を特異的に認識する酵素であることが明らかとなった。従って本酵素をLTB412-hydroxydehydrogenaseと命名した。本酵素のLTB4に対するKm値は8 g、精製度は約10,000倍であった。本酵素はSDS-PAGE,ゲル濾過カラム上、共に約35kDaの分子量を示したため、単量体タンパク質であると考えられた。精製した酵素を用いて、酵素学的な解析を行ったところ、本酵素はLTB4の12(R)の構造を持つ水酸基を特異的に認識する酵素であることが明らかとなった。従って本酵素をLTB412-hydroxydehydrogenaseと命名した。本酵素のLTB4に対するKm値は8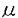 M,Vmaxは10nmol/min.mg proteinであった。本反応は補酵素としてNADP+を必要とするが、NADP+に対するKm値は1.5 M,Vmaxは10nmol/min.mg proteinであった。本反応は補酵素としてNADP+を必要とするが、NADP+に対するKm値は1.5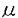 Mであった。また精製酵素をエンドペプチダーゼであるLys-Cにて消化して、アミノ末端と内部の部分アミノ酸配列を決定したところ、これまでに報告のない新規のタンパク質であることが明らかとなったため、本酵素のcDNAのクローニングを試みた。 Mであった。また精製酵素をエンドペプチダーゼであるLys-Cにて消化して、アミノ末端と内部の部分アミノ酸配列を決定したところ、これまでに報告のない新規のタンパク質であることが明らかとなったため、本酵素のcDNAのクローニングを試みた。 得られたアミノ酸配列をもとにしてオリゴヌクレオチドを合成し、これをプライマーにしたPCR法によって、N末端付近をコードする220bpのcDNAフラグメントを得た。これをプローブにして、ブタの腎臓から作成したcDNAライブラリーをスクリーニングして本酵素の全長をコードしているcDNAを得た。本酵素のcDNAは987bpの翻訳領域をもち、コードされているアミノ酸は329個、計算上の分子量は35,761であった。データベースを検索したところ、これまでに報告のない新規のcDNAであったが、アルコール脱水素酵素とアミノ酸レベルで30%程度の弱い相同性を持ち、なかでも、アルコール脱水素酵素のNAD+/NADP+との結合に必要とされるコンセンサス配列を有していた。またブタの本酵素のcDNAをプローブにしてヒトの腎臓のcDNAライブラリーをスクリーニングしてヒトLTB412-hydroxydehydrogenaseのcDNAを得た。 発現ベクター(pGEX-1)に得られたブタのcDNAをサブクローニングして大腸菌JM109を形質転換させ、0.1mM IPTGでタンパク質を発現させた。発現タンパク質はGST(glutathione-S-transferase)との融合タンパク質として発現させたため、GSHアフィニティカラムを用いて組み替えタンパク質を精製することができた。GSHカラムによって約80%程度に精製されたタンパク質は、精製標品と同程度の酵素活性を持っており、このcDNAがLTB412-hydroxydehydrogenaseをコードしていることが確認された。 この酵素によってLTB4から作られる12-oxo-LTB4はヒト白血球の細胞内カルシウム上昇作用においてLTB4の約100分の1の活性を持つにとどまり、本酵素がLTB4の不活性化酵素であることが明らかとなった。 III考察 LTB4は主として白血球で産生される生理活性脂質であり、nMという極めて低い濃度で白血球の遊走、血管内皮への吸着、白血球内の諸酵素の放出を促進するといった白血球活性化の生理作用を持ち、炎症のメディエイターとされている。その生理活性の強さから、代謝経路も生物学的に重要であると考えられ、ヒト白血球に存在するチトクロームP450LTB4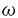 が、LTB4を20-hydroxy-LTB4に変換することが過去に明らかにされていた。この代謝経路は が、LTB4を20-hydroxy-LTB4に変換することが過去に明らかにされていた。この代謝経路は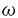 酸化と呼ばれて、その初発酵素であるチトクロームP450LTB4 酸化と呼ばれて、その初発酵素であるチトクロームP450LTB4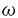 はcDNAがクローニングされ、一次構造が明らかになっている。このチトクロームP450LTB4 はcDNAがクローニングされ、一次構造が明らかになっている。このチトクロームP450LTB4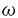 はヒト多形核白血球のみに存在し、他の臓器には存在しないことも明らかにされていた。ところが近年、自己免疫性腎炎の腎臓や尋常性乾癬の皮膚においてLTB4の産生が増加していることが明らかになった。これらの臓器にはチトクロームP450LTB4 はヒト多形核白血球のみに存在し、他の臓器には存在しないことも明らかにされていた。ところが近年、自己免疫性腎炎の腎臓や尋常性乾癬の皮膚においてLTB4の産生が増加していることが明らかになった。これらの臓器にはチトクロームP450LTB4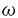 は存在せず は存在せず 酸化とは異なる代謝経路の存在が示唆されていた。本研究において精製され、一次構造が決定されたLTB412-hydroxydehydrogenaseはヒト、ブタ、モルモットにおいて、腎臓や肝臓に高い発現が見られ、大腸、小腸、卵巣、精巣といった臓器にも広く分布し、これらの臓器においてLTB4の代謝に関与している酵素であると考えられる。本酵素によって生成される12-oxo-LTB4はヒト白血球における細胞内カルシウム上昇作用においてLTB4に比べて約100分の1以下の活性を持つにとどまり、この代謝経路がLTB4の不活性化を行う経路であることが明らかになった。 酸化とは異なる代謝経路の存在が示唆されていた。本研究において精製され、一次構造が決定されたLTB412-hydroxydehydrogenaseはヒト、ブタ、モルモットにおいて、腎臓や肝臓に高い発現が見られ、大腸、小腸、卵巣、精巣といった臓器にも広く分布し、これらの臓器においてLTB4の代謝に関与している酵素であると考えられる。本酵素によって生成される12-oxo-LTB4はヒト白血球における細胞内カルシウム上昇作用においてLTB4に比べて約100分の1以下の活性を持つにとどまり、この代謝経路がLTB4の不活性化を行う経路であることが明らかになった。 本酵素は12(R)の構造を持つdihydroxyeicosatetraenoic acidのみを基質とすることから、LTB4に特異的に働く酵素であるといえる。一次構造上も、他のアルコール脱水素酵素群と35%程度の弱い相同性を持つにとどまるのに対して、ヒトとブタの間で83%(アミノ酸レベル)の相同性を持つ極めて良く保存されたタンパク質であり、新しいファミリーを形成している可能性が高い。補酵素としてNADP+を利用する本酵素は、他のNAD+/NADP+依存性のアルコール脱水素酵素で証明されている補酵素の結合部位を比較的良く保存された形で有している点でも興味深い。 LTB4は炎症性疾患を引き起こす物質の一つであるとされているが、その詳細なメカニズムは未だに不明である。今回LTB412-hydroxydehydrogenaseのcDNAがクローニングされたことが、未だに不明な点が多いLTB4の生体内における役割を解明する一助となることが期待される。 IV結語 1.LTB4はブタの腎臓においてはLTB4よりも生物活性の低い12-oxo-LTB4に代謝されることが明らかとなった。 2.LTB4を特異的に認識して12-oxo-LTB4に変換するLTB412-hydroxydehydrogenaseをブタの腎臓から単一標品にまで精製した。 3.ブタとヒトのLTB412-hydroxydehydrogenaseのcDNAをクローニングし、本酵素の一次構造を決定した。ブタの酵素は329個のアミノ酸からなり、計算上の分子量は35,761であった。ヒトにおいてmRNAの臓器分布を調べたところ、腎臓と肝臓に極めて高い発現が見られたほか、大腸、小腸、前立腺、卵巣、精巣にも弱い発現が見られた。 4.LTB412-hydroxydehydrogenaseのcDNAをpGEX-1ベクターに組み込み、大腸菌JM109で発現させた。組み替えタンパク質は酵素活性を有し、天然の酵素と同様の触媒的性質を示した。 5.cDNAのクローニングと発現システムの開発により、LTB4の生理的意義の解明が期待される。 |