本研究は、抗原特異的なT細胞活性化のために不可欠なcostimulatory signalを最も効率的に与えることのできるとされるCD28分子に対してCD80(B7/BB1)以外のリガンドが存在することを、この新しい分子を認識するモノクローナル抗体IT2を作製することによって示し、この新しい分子をB70と名付けて発現および機能解析を行ったものであり、下記の結果を得ている。 1.抗B70抗体IT2は、ヒトEBV変異B細胞株JYに対するヒトNK様白血病細胞株YT2C2のCD28依存性細胞傷害活性を、単独で部分的に、抗CD80抗体との共存下でほぼ完全に阻害した。この細胞傷害活性は抗CD28抗体によって完全に阻害されること、またCD80のもうひとつの受容体であるCTLA-4をYT2C2が発現していないことから、B70分子はCD28のリガンドであることが示された。 2.ImmnoprecipitationとWestem blottingを行ったところ、B70分子は分子量約70kD、コアペプチド約40kDの単量体の糖タンパクで、その予想されるアミノ酸配列からCD80とは全く別の分子であり、CD80と無関係に発現してCTLA-4と直接結合できることが分かった。抗B70抗体は、JYに対するキメラ融合タンパクCTLA4-Igの結合を単独で部分的に、抗CD80抗体との共存下でほぼ完全に阻害した。 3.B70は、ヒトB細胞株、骨髄腫細胞株、および単球細胞株においてCD80と共発現されていたが、T細胞株およびプレB白血病細胞株上には発現されていなかった。CD80とB70は、静止期T細胞およびB細胞においては発現されていなかったが、活性化刺激によっていずれも容易に増強された。CD80と異なり、ヒト末梢血単球および樹状細胞においてはB70が恒常的に発現されていた。サイトカイン等の刺激によってこれらはいずれも著しく誘導・増強されたが、スーパー抗原によるMHCクラスIIを介した刺激ではB70のみが増強された。この結果、抗原提示細胞におけるCD80とB70の発現制御は明らかに異なっていることが示された。 4.静止期T細胞とアロ末梢血単球を10日間共培養し、単球上のCD80とB70の発現誘導の動態をフローサイトメトリー解析したところ、T細胞と単球の相互作用の過程を通じてB70はCD80より優位に発現されていることが明らかになった。 5.CD80またはB70を遺伝子導入したCOS7細胞に対するキメラタンパクCD28-IgおよびCTLA4-Igの反応性をフローサイトメトリー解析したところ、受容体に対する結合親和性においてCD80とB70はほぼ同等であることが示された。 6.B70を遺伝子導入したP815細胞は、T細胞増殖反応、T細胞によるIL-2および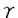 -インターフェロン産生、および細胞障害性Tリンパ球誘導を、CD80-P815とほぼ同等に強力に刺激することができた。これらの反応は、抗CD80または抗B70抗体によってほぼ完全に阻害された。この結果から、CD80とB70は同等のcostimulatory potentialを有していることが示された。 -インターフェロン産生、および細胞障害性Tリンパ球誘導を、CD80-P815とほぼ同等に強力に刺激することができた。これらの反応は、抗CD80または抗B70抗体によってほぼ完全に阻害された。この結果から、CD80とB70は同等のcostimulatory potentialを有していることが示された。 7.末梢血静止期単球または樹状細胞に刺激されるアロT細胞増殖反応はいずれも、抗CD80抗体によっては部分的に抑制されたのみであったのに対して、抗B70抗体または抗CD28抗体によってほぼ完全に阻害された。この結果から、生体内でのT細胞活性化においてはB70がより重要であることが示された。CD80とB70のこのような機能的重要性の差は、先に示されたようにcostimulatory moleculeとしての機能の差によるのではなく、免疫応答の過程における発現誘導の動態の違いによっていると考えられた。 以上、本論文はT cell costimulationに関与する新しいリガンド分子B70を同定し、免疫担当細胞における発現分布と機能を解析してT細胞依存性免疫応答におけるこの分子の機能的重要性を明らかにした。本研究は、T cell costimulationにおけるmultiple receptor/ligand relationshipを解明し、さらにT細胞活性化の制御機構を理解するうえで多大な貢献をなすと考えられ、学位の授与に値すると考えられる。 |