| 内容要旨 | | 調整が容易なリチウムジアルキルアミドは、合成反応上有用な強塩基である。エナンチオ選択的不斉反応への展開を目指して開発されたキラルリチウムアミドは、脱プロトン化剤であると同時に、生成するキラルアミンに不斉配位子としての機能が期待される。当教室では、多座配位型キラルリチウムアミドを用いて種々のエナンチオ選択的不斉反応の検討を行っている。カルボニル化合物を基質とするアルドール反応における検討では、acetophenoneとbenzaldehydeを基質とし、リチウムに対し形式上二座配位型キラルリチウムアミドが高い不斉収率を与えたことを報告した。1 系内に生成したリチウムエノラートとキラルリチウムアミドが形成したMixed Aggregateが有効な不斉空間を構築し、高い不斉収率が得られたと考えられた。アルドール反応は基本的炭素-炭素結合形成反応の一つであり、連続した不斉点が形成可能である(eq.1)。しかし、二座配位型キラルリチウムアミドを用いた検討においてはカルボニルの 位に置換基を持つ基質は低い選択性しか与えず、連続不斉点形成は課題であった。 位に置換基を持つ基質は低い選択性しか与えず、連続不斉点形成は課題であった。 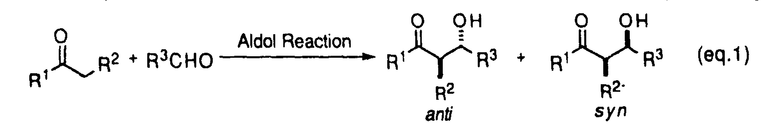 (eq.1) (eq.1) 私は、 位に置換基を持つ鎖状エステルを基質としたエナンチオ選択的不斉アルドール反応の検討を行い、LDAでの脱プロトン化により生成した(E)-エノラートに対し四座配位型キラルリチウムアミドを不斉配位子として用いることで、高いエナンチオ選択性で連続不斉誘起に成功したことを報告する。 位に置換基を持つ鎖状エステルを基質としたエナンチオ選択的不斉アルドール反応の検討を行い、LDAでの脱プロトン化により生成した(E)-エノラートに対し四座配位型キラルリチウムアミドを不斉配位子として用いることで、高いエナンチオ選択性で連続不斉誘起に成功したことを報告する。 1.リチウムエノラートの(E)/(Z)比 先にtert-butyl propionate(2)を基質とし、リチウムカチオンに対し四座配位型キラルリチウムアミド1bを2.5当量用いてbenzaldehydeと反応を行った結果、anti体を収率66%、不斉収率94%ee、syn体を収率14%、不斉収率27%eeで得たことを見出した(eq.2)。 エステル(2)のリチウムエノラートには(E)、(Z)の立体異性体が存在する可能性があり、本反応におけるアルドール生成物のジアステレオ選択性とリチウムエノラートの(E)/(Z)比の間に関連性が予想された。1bは塩基性が弱く、-78℃では基質の脱プロトン化の進行が遅いため、THF中-20℃で脱プロトン化を行い、-78℃に冷却後TBDMSClで処理したところ、シリルエノールエーテル(4)が収率83%、(E)/(Z)比は91/9で得られた(eq.3)。対応するアルドール生成物(3)  anti体/syn体の比が82/18であり、ほぼ(E)/(Z)比を反映した値と考えられる。六員環遷移状態を経由して反応が進行したと考えると、2(E)-体からanti体が生成する過程で、1bは高い不斉収率を与える不斉空間を形成することが示唆された。 anti体/syn体の比が82/18であり、ほぼ(E)/(Z)比を反映した値と考えられる。六員環遷移状態を経由して反応が進行したと考えると、2(E)-体からanti体が生成する過程で、1bは高い不斉収率を与える不斉空間を形成することが示唆された。  図表(eq.2) / (eq.3)2.不斉配位子の検討 図表(eq.2) / (eq.3)2.不斉配位子の検討 THF中-78℃でさらに高い(E)/(Z)比を与えるLDAで脱プロトン化を行い、3本反応における不斉配位子の検討を行った(Table 1)。LDAで脱プロトン化した後、キラルアミン1aを用いたところ、不斉収率は0%eeであった(run1)。キラルリチウムアミド1bを用いると、大幅な不斉収率の向上が見られた(run2)。1aとLiBrのcomplexでは、4不斉誘起は見られなかった(run3)。以上より本反応においてキラルリチウムアミド1bが高い不斉誘起に関与することが示された。  Table 1 Effect of Chiral Lithium Amide as a Ligand for Lithium Enolate Table 1 Effect of Chiral Lithium Amide as a Ligand for Lithium Enolate 更に種々の側鎖を有するキラルリチウムアミドを用いて本反応の検討を行った(Table2)。主生成物であるanti体の不斉収率について注目すると、側鎖に配位性原子を持たない二座配位型では低い不斉収率であったが(run1)、Yに配位性原子を導入した三座配位型にすることで不斉収率の向上が見られた(run2、3)。Yからエチレンユニットを伸ばしたZに配位性原子を導入した三座配位型では不斉収率は低下し(run4、5)、配位性原子を持たない二座配位型とほぼ同じ値を示した(run6)。Yに配位性原子を導入し更に炭素数を伸ばした三座配位型を用いたところ、大幅な不斉収率の向上が見られた(run7)。Y、Zともに配位性原子を持つ四座配位型にすることでanti体を94%eeで得ることができた(run8)。  Table2 Asymmetric Aldol Reaction Mediated by Various Chiral Lithium Amides Table2 Asymmetric Aldol Reaction Mediated by Various Chiral Lithium Amides 四座配位型では、Zに配位性が弱いと考えられるOPh基を導入すると、三座配位型とほぼ同じ値を示した(run9)。Zを酸素から窒素に変えたところ、同じ94%eeでanti体が得られたが(run10)、窒素上の置換基を立体的に大きくすると不斉収率の低下が見られた(run11、12)。また、Yを酸素から窒素に変えると、不斉収率は低下した(run13)。 以上より、Y部分は酸素原子、Z部分は立体的に小さい配位性原子を有する四座配位型キラルリチウムアミドが最適であることが示された(run8、10)。 3.基質の検討 (E)-エノラートを主に生成すると考えられる種々のエステル(methyl phenylacetateなど)を基質とし、LDAで脱プロトン化した後、1bを不斉配位子として用いてbenzaldehydeとの反応を行った。いずれも主生成物はanti体であり、82〜90%eeと高い不斉収率で得られた。一方(Z)-エノラートを主に生成すると文献上知られているpropiophenone、 N,N-dimethylacetamideを基質としたところ、5主生成物はsyn体となり12〜39%eeと低い不斉収率であった。本反応において、優先的に(E)-エノラートが生成可能であればanti体が高い不斉収率で得られることが確認された。 2を基質とし、種々のアルデヒドとの反応を行ったところ、いずれもanti体が主生成物として、93〜96%eeと高い不斉収率で得られた(Table3)。エノラートの固定した面に対しアルデヒドが同一方向から反応した結果と考えられる。 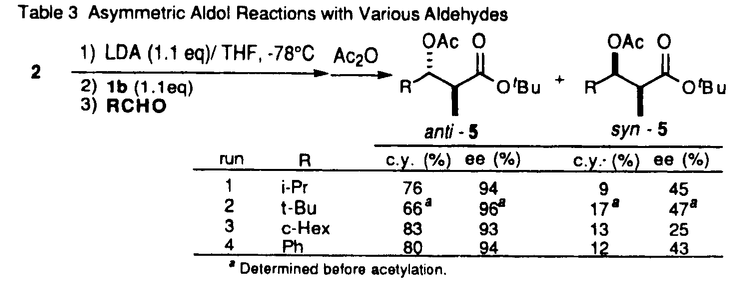 Table3 Asymmetric Aldol Reactions with Various Aldehydes Table3 Asymmetric Aldol Reactions with Various Aldehydes 更に、基質の適用範囲の拡大として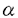 位に酸素官能基を有する基質を用いた。 位に酸素官能基を有する基質を用いた。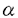 -benzyloxyesterでは満足のいく結果は得られなかったが、 -benzyloxyesterでは満足のいく結果は得られなかったが、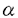 -silyloxy esterを用いることで高い不斉収率を得ることができた(Table4)。 -silyloxy esterを用いることで高い不斉収率を得ることができた(Table4)。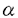 -silyloxy esterから(E)-エノラートを優先的に生成させることができたため、本反応に適応できた結果と考えられる。 -silyloxy esterから(E)-エノラートを優先的に生成させることができたため、本反応に適応できた結果と考えられる。  Table4 Enantioselectivity of the Aldol Reactions of Table4 Enantioselectivity of the Aldol Reactions of  -Silyloxy Esters4.イミンへの不斉付加反応 -Silyloxy Esters4.イミンへの不斉付加反応 エステルを基質とし、アルデヒドの等価体であるイミンへの不斉付加反応の検討を行った(Table5)。エステル部分を立体的に大きくすることでより高い不斉収率を得ることができた(run2)。さらに、キラルアミン1aが不斉配位子としての機能を有する事が判明したため、LDAで脱プロトン化し、1aを触媒とする反応を行った。検討の結果、1aを0.1当量用いて収率86%、不斉収率45%eeで7を得ることができた。 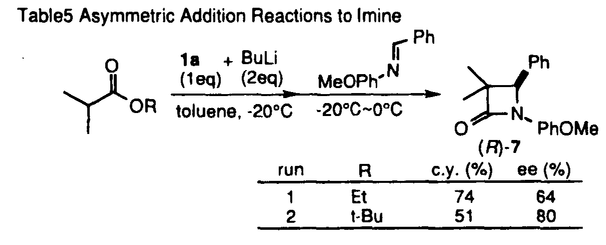 Table5 Asymmetric Addition Reactions to Imine5.結論 Table5 Asymmetric Addition Reactions to Imine5.結論 エナンチオ選択的不斉アルドール反応において、LDAと四座配位型キラルリチウムアミド1bを用いることで、(E)-エノラートから高い不斉収率でanti体を得ることに成功した。 本反応における反応中間体は、(E)-エノラートと1bが形成するMixed Aggregateであることが示唆される。高い不斉収率は、(E)-エノラートのリチウムカチオンに1bの側鎖に存在する配位性原子が配位することでMixed Aggregateが強固に固定され、benzaldehydeが六員環遷移状態をとりながら(E)-エノラートの立体的に空いた面から反応した結果、得られたと考えられる。 また、四座配位型キラルアミン1aを用いたイミンへのエナンチオ選択的不斉付加反応の開発を行い、キラルアミンの触媒化の可能性を見出すことができた。 文献1.M.Muraoka,H.Kawasaki,and K.Koga,Tetrahedron Lett.,29,337(1988).2.H.E.Zimmerman and M.D.Traxler,J.Am.Chem.Soc.,79,1920(1957).3.R.E.Ireland,R.H.Muller,and A.K.Willard,J.Am.Chem.Soc.,98,2868(1976).4.M.Murakata,M.Nakajima,and K.Koga,J.Chem.Soc.,Chem.Commun.,1990,1657.5.C.T.Buse,W.A.Kleschick,M.C.Pirrung,J.E.Sohn,J.Lampe,and C.H.Heathcock,J.Org.Chem.,45,1066(1980). |
| 審査要旨 | | カルボニル基の 位での炭素‐炭素結合形成反応は、有機合成化学の基本的な反応である。この反応によって新たな不斉炭素が生成するとき、その立体化学を制御する事は極めて重要である。本研究は、キラルなリチウムアミドを設計、合成し、これを用いてアルドール反応をエナンチオ選択的に行い、連続した2個の不斉炭素を有する生成物を不斉合成する方法の開拓を行ったものである。 位での炭素‐炭素結合形成反応は、有機合成化学の基本的な反応である。この反応によって新たな不斉炭素が生成するとき、その立体化学を制御する事は極めて重要である。本研究は、キラルなリチウムアミドを設計、合成し、これを用いてアルドール反応をエナンチオ選択的に行い、連続した2個の不斉炭素を有する生成物を不斉合成する方法の開拓を行ったものである。  図表 図表 先ず、本不斉反応に有効なキラルリチウムアミドの検索を行い、多座配位子型のキラルリチウムアミド(1,2)を種々合成した。 tert-butyl propionateとbenzaldehydeとのアルドール反応を行った結果をTable1に示す。二配座型アミド(1b)の窒素上の置換基Rに炭素2個をはさんでエーテル酸素(2a)あるいはアミノ窒素(2b)を導入すると、主生成物であるアンチ体のエナンチオ選択性が上昇した。さらにこれらの配位子機能を有する酸素または窒素置換基を導入すると、エナンチオ選択性は大きく上昇した(run4,5)。しかし、このR基の長さは同じであるものの、配位子機能を持つ官能基が存在しないと、エナンチオ選択性は減少した。  Table 1 The Aldol Reaction of tert-Butyl Propionate using Chiral Lithium Amides Table 1 The Aldol Reaction of tert-Butyl Propionate using Chiral Lithium Amides 2dを用いて脂肪族アルデヒドの不斉アルドール反応を同様に行った結果をTable2に示す。アンチ体について、ほぼ同様の選択性が得られることが判明した。  Table 2 The Aldol Reaction of tert-Butyl Propionate with Various Aldehydes Promoted by 2d Table 2 The Aldol Reaction of tert-Butyl Propionate with Various Aldehydes Promoted by 2d 四配座型キラルリチウムアミドが有効である事実は、Figure 1に示すような混合会合体が反応系に生成していることを強く示唆している。 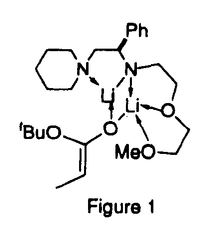 Figure1 Figure1 以上、本研究はキラルリチウムアミドを用いるエナンチオ選択的な不斉アルドール反応に新しい知見を加えたもので、有機合成化学に寄与するものであり、博士(薬学)に値するものであると認める。 |