【序】ブレオマイシン(BLM)は1966年梅沢らにより単離された抗腫瘍性抗生物質で、扁平上皮癌、悪性リンパ腫等の治療に広く用いられている。これまでの研究結果から、BLMの各部位はそれぞれ下図に示すような役割を担い、分子全体で協奏的にDNAを酸化的に切断することで抗腫瘍活性の発現に寄与していると考えられている。  Fig.1 Proposed Structure for BLM-Fe(II)-O2 Complex and Mechanism of Action Fig.1 Proposed Structure for BLM-Fe(II)-O2 Complex and Mechanism of Action BLMの糖部位は2-O-(3-O-カルバモイル- -D-マンノピラノシル)- -D-マンノピラノシル)- -L-グロースという他の制癌性抗生物質には見られない特異な二糖である。この部位は、BLM鉄錯体の酸素活性化の際の立体環境因子として働くほかに細胞膜透過性や癌細胞への移行性にも関与しているものと推定される。しかしながら、この糖部位に関しては、これまで構造活性相関はもとより合成化学的な取り組みも殆どなされていなかった。この理由は、一つには多くの研究者の興味がBLMの金属結合部位による酸素活性化とDNA切断に集中していたためと言えるが、 -L-グロースという他の制癌性抗生物質には見られない特異な二糖である。この部位は、BLM鉄錯体の酸素活性化の際の立体環境因子として働くほかに細胞膜透過性や癌細胞への移行性にも関与しているものと推定される。しかしながら、この糖部位に関しては、これまで構造活性相関はもとより合成化学的な取り組みも殆どなされていなかった。この理由は、一つには多くの研究者の興味がBLMの金属結合部位による酸素活性化とDNA切断に集中していたためと言えるが、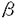 -ヒドロキシヒスチジン部位に糖を導入することが困難であったためにこの部分の研究が立ち遅れてきたのも事実である。そこで、筆者は、このBLM糖部位の機能を合成化学的に解明することを目指して本研究に着手した。 -ヒドロキシヒスチジン部位に糖を導入することが困難であったためにこの部分の研究が立ち遅れてきたのも事実である。そこで、筆者は、このBLM糖部位の機能を合成化学的に解明することを目指して本研究に着手した。 【糖の導入法の検討】本研究を進める上で重要な課題となるのは、BLMの二糖部分の効率的な合成とヒドロキシヒスチジンへの糖の導入である。先ず、後者に関して、汎用性の高い方法の確立を目指し、単純化した系としてD-マンノース、D-グルコースなどの単糖の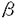 -ヒドロキシヒスチジンへの導入を試みた。その結果、ヒドロキシヒスチジンのイミダゾール環上の -ヒドロキシヒスチジンへの導入を試みた。その結果、ヒドロキシヒスチジンのイミダゾール環上の 窒素をトリチル基、 窒素をトリチル基、 -アミノ基をアジドの形で保護したヒドロキシヒスチジン等価体1を糖受容体とし、D-グルコース、D-マンノース、D-ガラクトースより調製したトリクロロアセトイミダート体をルイス酸存在下反応させると、対応するグリコシドが良好な収率で得られることを見出した。 -アミノ基をアジドの形で保護したヒドロキシヒスチジン等価体1を糖受容体とし、D-グルコース、D-マンノース、D-ガラクトースより調製したトリクロロアセトイミダート体をルイス酸存在下反応させると、対応するグリコシドが良好な収率で得られることを見出した。  Fig.2 Glycosylation of Hydroxyhistidine Synthon and Synthesis of Glyco-PYML-6 Fig.2 Glycosylation of Hydroxyhistidine Synthon and Synthesis of Glyco-PYML-6 更に、アジドの還元、ピリジンカルボン酸4との縮合の後、脱保護することによって、モデル配位子(PYML-6)に糖を導入することが出来た。これらの化合物はESRスピントラッブ法による測定の結果、BLMと同程度の酸素活性化能を示した。この結果は、糖の存在が酸素付加体の二量化を防いでいるという従来からの推察とよく一致するものである。 【二糖部位の合成】 二糖の合成に際してはL-グロースの効率的な合成法の確立が最大の課題であった。既存の方法としては、L-グロースがD-グルコースの1位と6位の酸化状態が入れ替わった立体構造を持つことに着目し、両者の酸化状態を入れ替える合成法が報告されているが、工程数が多く効率面で課題が残されている。他方、L-グロースはD-マンノースの5位水酸基の立体配置のみが反転した化合物と見做すことが出来る。筆者はこの点に着目し、L-グロース部分を新たにD-マンノースより誘導しつつBLM糖部位を合成することが可能であると考えた。以下にその逆合成解析を示す。 L-グロースシントンとしては、Fig.3に示したアリルアルコール体5を想定した。予め2位水酸基を他と区別したD-マンノースのヘミアセタール体7を出発物質とし、1位をオレフィン化してアルデヒドを保護する。開環に伴ってフリーとなった5位の水酸基の立体を反転させ、アリル位の水酸基の保護基を除去すると5が得られると思われる。この化合物が糖受容体となるわけだが、グリコシル化に与るのは反応性に富むアリル位の水酸基であるため、マンノース部位との縮合は円滑に進行するものと期待出来る。さらに、オレフィン化により一時的に保護したL-グロースのアノマー位はオゾン分解によって容易にアルデヒドに戻すことが出来る筈である。  Fig.3 Retrosynthetic Analysis of the Disaccharide Moiety of BLM Fig.3 Retrosynthetic Analysis of the Disaccharide Moiety of BLM 本アプローチの妥当性を検証するため、2位を区別していないD-マンノースで先ず条件検討を行なうこととした。マンノースの2,3,4,6位の水酸基を保護した後、ヘミアセタールをメチレントリフェニルホスホランと反応させてアノマー位をエキソメチレンの形で保護すると同時に開環した。5位の水酸基の立体配置の反転は種々検討した結果、酸化・還元によって達成することが出来、L-グロースの新規合成法の確立に成功した。  Fig.4 Preparation of L-Gulose from D-Mannose Fig.4 Preparation of L-Gulose from D-Mannose そこで、この方法を予め2位を区別して保護したマンノース誘導体12に適用してグロースシントン14を合成した。この化合物を別途合成したマンノースシントン15と縮合し、更に3工程を経ることによりBLMの二糖部分を合成する新規のルートを確立した。グロース等価体14は反応性に富んだアリルアルコールであるため、マンノース部位とのグリコシル化は極めて速やかに進行し、所望のアノマーのみを良好な収率で得ることが出来るのが、本方法の特徴である。  Fig.5 Synthesis of the Disaccharide Moiety of BLM Fig.5 Synthesis of the Disaccharide Moiety of BLM 【ヒドロキシヒスチジン部位との縮合】このようにして得られたヘプタアセタート体18はアノマー位のみを選択的に脱保護した後、トリクロロアセトイミダート体19に誘導してヒドロキシヒスチジン誘導体1と縮合させた。この反応は活性化剤としてTMSO Tfを用いることにより37%と低収率ながらも進行し、所望の -アノマー20を単一生成物として得ることに成功した。さらに、アジドの還元、ピリジンカルボン酸4との縮合、脱保護を行うことにより標的化合物21を合成することが出来ると考えている。 -アノマー20を単一生成物として得ることに成功した。さらに、アジドの還元、ピリジンカルボン酸4との縮合、脱保護を行うことにより標的化合物21を合成することが出来ると考えている。  【総括】このように、筆者はBLM糖部位の機能を明らかにすることを目的として本研究を行ってきた。その過程で、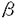 -ヒドロキシヒスチジン等価体に種々の単糖を導入する方法を確立した。さらに単糖を導入したモデル配位子(Glyco-PYML-6)を合成し、これらの酸素活性化能を測定することにより、糖部位が酸素活性化の際に立体環境因子として働くという従来からの説を強く支持する結果を得ることが出来た。また、新たにD-マンノースよりL-グロースを合成する方法を開発し、これを用いてBLMの糖部位の新規合成法を確立した。更に、この二糖をヒドロキシヒスチジン等価体に導入することにも成功した。標的化合物21の合成にはアジドの還元、4との縮合、脱保護の工程を残すものの合成上の本質的な課題は一応解決出来たものと思われる。更に21とグルコース等の種々の糖を導入したPYML-6の癌細胞への取り込みを比較することで、BLM糖部位の果たす役割を明らかにすることが可能であると考えている。 -ヒドロキシヒスチジン等価体に種々の単糖を導入する方法を確立した。さらに単糖を導入したモデル配位子(Glyco-PYML-6)を合成し、これらの酸素活性化能を測定することにより、糖部位が酸素活性化の際に立体環境因子として働くという従来からの説を強く支持する結果を得ることが出来た。また、新たにD-マンノースよりL-グロースを合成する方法を開発し、これを用いてBLMの糖部位の新規合成法を確立した。更に、この二糖をヒドロキシヒスチジン等価体に導入することにも成功した。標的化合物21の合成にはアジドの還元、4との縮合、脱保護の工程を残すものの合成上の本質的な課題は一応解決出来たものと思われる。更に21とグルコース等の種々の糖を導入したPYML-6の癌細胞への取り込みを比較することで、BLM糖部位の果たす役割を明らかにすることが可能であると考えている。 |