触媒的不斉合成反応は、微量の不斉源から大量の光学活性体を合成しうる方法であり、理想的な反応系を開発できれば、もっとも効率の良い光学活性体の供給法となるものと期待できる。本研究では、様々な医薬品の部分構造として知られるデカリン誘導体を合成するために、プロキラルなアリルアルコール体1、エノン体6及びジエン体12を基質とする不斉Heck反応をデザインした。すなわち、アリルアルコール体1に対してパラジウム触媒を用いれば、アルケニルトリフレートがパラジウムに酸化的付加した後、パラジウム-炭素結合にオレフィンの挿入が起こり、アルキルパラジウム中間体3を与える。この時、パラジウムはシン脱離をするため -配置の水酸基を有する場合には -配置の水酸基を有する場合には -水素脱離することができエノール体4を経由して5を与えることになる。 -水素脱離することができエノール体4を経由して5を与えることになる。 又、エノン体6に対してはアルケニルトリフレートがパラジウムに酸化的付加した後、オレフィンの挿入、oxo-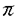 -アリル中間体9を経由し、10より続くシン- -アリル中間体9を経由し、10より続くシン- -水素脱離によりジエノン体11を与えることになる。 -水素脱離によりジエノン体11を与えることになる。 さらに、ジエン体12に対してパラジウム触媒を用いればアリールトリフレートが酸化的付加した後、オレフィンaの挿入反応が起こり三環性化合物14を与えるはずである。  図表Scheme1 / Scheme2 図表Scheme1 / Scheme2 Scheme3 Scheme3 まず、アリルアルコール体15の不斉閉環反応を検討した結果、不斉配位子としてはBINAPを用い、Table 1,2に示すように、溶媒としては1,2-ジクロロエタンを用いた場合に最も高い不斉収率で閉環体16が得られることが分かった。 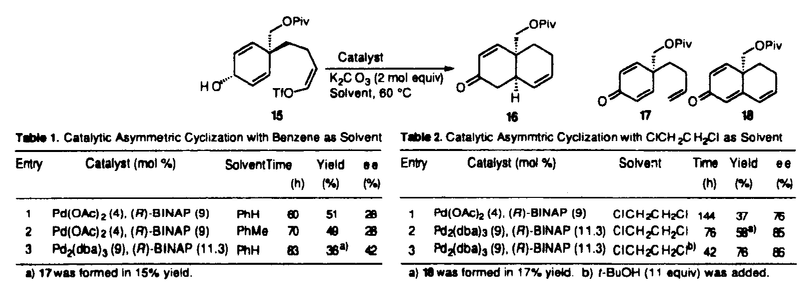 図表Table1.Catalytic Asymmetric Cyclization with Benzene as Solvent / Table2.Catalytic Asymmtric Cyclization with ClCH2CH2Cl as Solvent 図表Table1.Catalytic Asymmetric Cyclization with Benzene as Solvent / Table2.Catalytic Asymmtric Cyclization with ClCH2CH2Cl as Solvent しかしながら、1,2-ジクロロエタン中では、トリエノン体18が副生するためさらに最適化を行った結果、tert-ブタノールを反応系に添加することにより収率が向上することを見いだし、76%化学収率、86%不斉収率で16を得ることに成功した。1,2-ジクロロエタンとベンゼン系の溶媒とで反応の副生成物が違ってきており、その生成機構についても考察している。なお、閉環体16より共同研究者の生頼らは、(+)-vernolepin(23)の形式全合成と絶対配置の決定に成功している(Scheme4)。 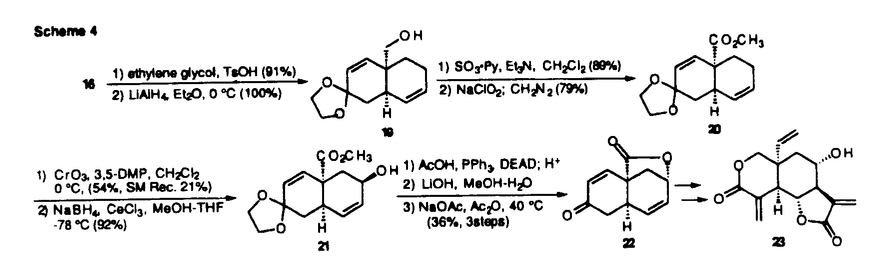 Scheme4 Scheme4 次に、エノン体24を基質とする不斉Heck反応を試み、この場合もアリルアルコール体15と同様の触媒系で40℃まで温度を下げても閉環反応が進行し、66%化学収率、83%不斉収率で閉環体18を得ることができた。閉環体18からはquassimarinアナログ26の中間体合成を行いトリエノン体18の有用性を示している。  Scheme5 Scheme5 ジエン体27の閉環反応の検討では、化学収率は41%と若干低いものの、94%不斉収率で目的とする閉環体28を得ている。閉環体28からはステロイド類に誘導可能な中間体29の合成を行っている。  Scheme6 Scheme6 以上、本研究は、アリルアルコール及びエノンをオレフィンコンポーネントとする不斉Heck反応に初めて成功し、さらに反応によって得られる官能基化されたデカリン誘導体がテルペン、ステロイド類などの有用生理活性物質に変換可能であることを示したもので、有機合成化学に寄与するところ大であり、博士(薬学)の学位に値する論文であると認めた。 |