| 内容要旨 | | 現在、使用されている医薬品の中でもとくに合成医薬品に関してはキラル化合物がラセミ体として使用されている場合が多い。薬物が体内の酵素や受容体などと相互作用するとき、酵素や受容体などの生体高分子は、キラル識別能力を有しているために、エナンチオマー間で活性の強さが異なったり、全く正反対の作用を有するなど、作用が異なる場合が多々知られている。そのような問題を避けるためにも、不斉点をもつ医薬品あるいは生理活性物質を高い光学純度でいかにして合成するかは、大変重要な問題である。 そこで、その方法論として我々の研究室では、理論的には触媒量の不斉源から無限の光学活性体を合成し得る触媒的不斉合成反応に着目した。その中でも炭素-炭素結合生成反応の開発を目的とした研究を開始し、1989年、はじめて不斉Heck反応の開発に成功した。その後、このパラジウム触媒を用いる不斉Heck反応を利用して種々の生物活性物質の合成へと展開している。 今回私は、鎮痛剤として広く臨床に用いられている(-)-エプタゾシン(1)、(-)-モルヒネ(2)また特異的な逆転写酵素阻害剤である(+)-ハレナキノール(3)などに共通の構造であるベンジル位の四級炭素を不斉Heck反応により構築する方法論を確立することに成功したので報告する。また、本方法論を用いた非麻薬性鎮痛薬(-)-エプタゾシン(1)の触媒的不斉合成にも成功し、(+)-ハレナキノール(3)の触媒的不斉合成についても検討中であるのであわせて報告する。  ChartI1.三置換オレフィンの立体化学が不斉Heck反応のエナンチオ選択性に与える影響 ChartI1.三置換オレフィンの立体化学が不斉Heck反応のエナンチオ選択性に与える影響 目的とするベンジル位四級炭素の構築法として、私は次のような方法を計画した。4のような化合物、即ち分子内にアリールトリフレートと三置換オレフィンをもつものを基質として分子内不斉Heck反応による閉環反応を行えば、目的とする不斉四級炭素を有する化合物5の合成が可能である(SchemeI)。  Scheme I Scheme I また、この閉環反応において三置換オレフィンが、(E)-、(Z)-体のいずれであるかによってエナンチオ選択性に非常に大きな影響を与える事が考えられる。そこで、まず(E)-、(Z)-体の両方を合成し閉環の際のエナンチオ選択性に与える影響を検討した。不斉Heck反応までの合成ルートはScheme IIに示す方法で行った。  Scheme IIReaction conditions:(a)TBDMSCl,Et3N,CH2Cl2,23℃,100%.(b)OsO4(catalyst),NalO4,THF-H2O,23℃;Ph3P=CHCOMe,benzene,50℃,84%(c)H2,Pd/C,EtOH,23℃,100%.(d)(EtO)2P(O)CH2CO2Et,NaH,THF,23°C,100%(8:9=4:1).(e)Dibal-H,Et2O,-78℃,71%;MOMCl,(i-Pr)2NEt,CH2Cl2,23℃,93%(R=MOM);TBDPSCl,Et3N,DMAP,CH2Cl2,23℃,91%(R=TBDPS).(f)TBAF,THF,0℃;Tf2O,Et3N,CH2Cl2,-78℃-0℃,90-95%.(g)Pd(0)-(S)BINAP complex(10mol%),K2CO3. Scheme IIReaction conditions:(a)TBDMSCl,Et3N,CH2Cl2,23℃,100%.(b)OsO4(catalyst),NalO4,THF-H2O,23℃;Ph3P=CHCOMe,benzene,50℃,84%(c)H2,Pd/C,EtOH,23℃,100%.(d)(EtO)2P(O)CH2CO2Et,NaH,THF,23°C,100%(8:9=4:1).(e)Dibal-H,Et2O,-78℃,71%;MOMCl,(i-Pr)2NEt,CH2Cl2,23℃,93%(R=MOM);TBDPSCl,Et3N,DMAP,CH2Cl2,23℃,91%(R=TBDPS).(f)TBAF,THF,0℃;Tf2O,Et3N,CH2Cl2,-78℃-0℃,90-95%.(g)Pd(0)-(S)BINAP complex(10mol%),K2CO3. 三置換オレフィンはHorner-Emmons反応を用いることによってE:Z=4:1の選択性で合成しそれぞれを分離して反応の検討を行った。まず、(E)-体10に関して閉環条件を詳細に検討した。結果は、溶媒としてはTHF、不斉リガンドはBINAP、塩基としては炭酸カリウムを用いたときに一番良い結果が得られることがわかった(Table I,run3)。しかし、化学収率は90%程度と良好ながら不斉収率は40%ee程度とあまり高い値は得られなかった。 また閉環体13はエノールエーテルのシス、トランスの混合物として得られ、それぞれを分離し不斉収率を測定したところ速度論的分割が起きていることが分かった。この値は、使用する不斉リガンドにより大きく変化し、特に(S,S)-BCPMを用いた場合にはシス-13が、速度論的分割の結果84%eeという高い不斉収率で得られたが、主生成物であるトランス-13の光学純度は15%eeと低いものであった(Table I,run5)。さらにアリルアルコールの保護基としてより嵩高いTBDPS基を持つ基質11の閉環反応を行なったが、不斉収率は51%eeとMOM体10に比べわずかに改善されるに止まった。 以上のように(E)-体10,11からは残念ながら高い不斉収率で目的とする閉環体が得られなかったので、次に(Z)-体12を用いて同様の反応条件で反応を行った。結果は、80%eeとある程度満足できる値が得られた(Table I,run8)。以上の結果より、Z-体12から高い選択性で目的物が得られることがわかったので、次に(Z)-体12の立体選択的合成法の検討を行った(Scheme III)。  Table I.Asymmetric Heck Cyclization of Aryl Triflate 10,11,12* Table I.Asymmetric Heck Cyclization of Aryl Triflate 10,11,12* 当初、ヨウ素体15からアルキル-亜鉛16を調製し、ビニルヨウ素体17とのパラジウム触媒を用いたクロスカップリング反応により(Z)-の三置換オレフィンを立体選択的に合成した(Scheme III,式1)。しかし再現性等に問題を残したためさらに検討を行なった結果、オレフィン体19にハイドロボレーションを行い、先と同様にクロスカップリング反応を行う方法がより有効であることが分かった(SchemeIII,式2)。(Z)-の三置換オレフィン12の効率的合成法を確立することができたので、さらなる不斉収率の向上をめざし反応条件の検討を行った。その結果、パラジウムアセテート10mol%、(R)-BINAP20mol%、炭酸カリウム3.0mol eq用いて、THF中50℃で反応を行った場合に化学収率97%,不斉収率91%eeという非常に良い結果が得られた(TableII)。この結果は、触媒的不斉合成反応として非常に満足できるものと考えている。  Scheme IIIReaction conditions:(a)Zn-Cu,BrCH2CH2Br(catalytic amount),THF.(b)17,Pd(PPh3)4(catalyst),THF,70℃,72%.(c)TBAF,THF,0℃;Tf2O,Et3N,CH2Cl2,-78℃-0℃,90%.(d)9-BBN,THF,0℃.(e)17,PdCl2(dppf).K2CO3,THF-DMF,50℃,80%. Scheme IIIReaction conditions:(a)Zn-Cu,BrCH2CH2Br(catalytic amount),THF.(b)17,Pd(PPh3)4(catalyst),THF,70℃,72%.(c)TBAF,THF,0℃;Tf2O,Et3N,CH2Cl2,-78℃-0℃,90%.(d)9-BBN,THF,0℃.(e)17,PdCl2(dppf).K2CO3,THF-DMF,50℃,80%. Table II.Asymmetric Heck Cyclization of Aryl Triflate 12* Table II.Asymmetric Heck Cyclization of Aryl Triflate 12* (Z)-体12から90%ee以上の高いエナンチオ選択性で目的物が得られる理由は、Figure Iに示したような遷移状態を考えることによってある程度考えることができる。三置換オレフィンのシリルエーテル部分がBINAPのフェニル基との立体障害を避ける遷移状態を通り反応が選択的に進行するものと考えることができる。  Figure I2.非麻薬性鎮痛薬(-)-エプタゾシンの触媒的不斉合成 Figure I2.非麻薬性鎮痛薬(-)-エプタゾシンの触媒的不斉合成 (-)-エプタゾシンはモルヒネと同様にオビオイド受容体を介して鎮痛作用を発現する。しかし、その作用が 受容体に選択的であることから、モルヒネのような麻薬性を示さないことが知られている。呼吸抑制作用や、消化管運動抑制作用などの副作用も弱い。また、国産開発の鎮痛薬であることからも注目されている。さて(-)-エプタゾシンは現在、光学分割によって(-)-体のエナンチオマーを分離し薬として用いている。今回私は不斉Heck反応を用いた触媒的不斉合成により欲しいほうのエナンチオマーのみを得ることに成功し、より効率よい合成法を確立することができた。不斉Heck反応で高いエナンチオ選択性を発現させるために先ほどの知見をいかし(Z)-三置換オレフィン22を立体選択的に合成し閉環反応を行うことを計画した。22の合成ルートはScheme IVに示した。 受容体に選択的であることから、モルヒネのような麻薬性を示さないことが知られている。呼吸抑制作用や、消化管運動抑制作用などの副作用も弱い。また、国産開発の鎮痛薬であることからも注目されている。さて(-)-エプタゾシンは現在、光学分割によって(-)-体のエナンチオマーを分離し薬として用いている。今回私は不斉Heck反応を用いた触媒的不斉合成により欲しいほうのエナンチオマーのみを得ることに成功し、より効率よい合成法を確立することができた。不斉Heck反応で高いエナンチオ選択性を発現させるために先ほどの知見をいかし(Z)-三置換オレフィン22を立体選択的に合成し閉環反応を行うことを計画した。22の合成ルートはScheme IVに示した。 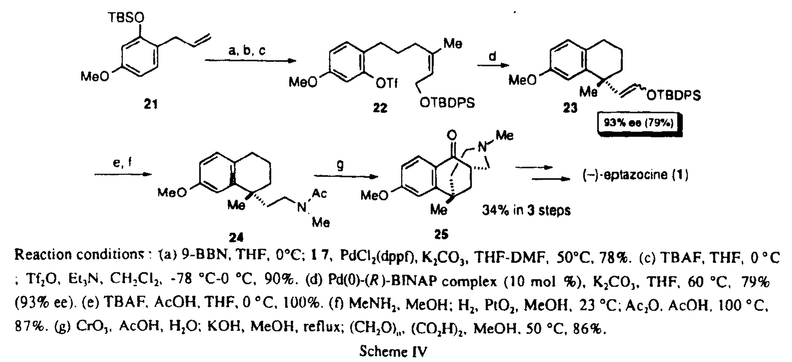 Scheme IVReaction conditions:(a)9-BBN,THF,0℃;17,PdCl2(dppf),K2CO3,THF-DMF,50℃,78%.(c)TBAF,THF,0℃;Tf2O,Et3N,CH3Cl2,-78℃-0℃,90%.(d)Pd(0)-(R)-BINAP complex(10mol%),K2CO3,THF,60℃,79%(93%ee).(e)TBAF,AcOH,THF,0℃,100%.(f)MeNH2,MeOH;H2,PtO2,MeOH,23℃;Ac2O,AcOH,100°C,87%.(g)CrO3,AcOH,H2O;KOH,MeOH,reflux;(CH2O)n,(CO2H)2,MeOH,50℃,86%. Scheme IVReaction conditions:(a)9-BBN,THF,0℃;17,PdCl2(dppf),K2CO3,THF-DMF,50℃,78%.(c)TBAF,THF,0℃;Tf2O,Et3N,CH3Cl2,-78℃-0℃,90%.(d)Pd(0)-(R)-BINAP complex(10mol%),K2CO3,THF,60℃,79%(93%ee).(e)TBAF,AcOH,THF,0℃,100%.(f)MeNH2,MeOH;H2,PtO2,MeOH,23℃;Ac2O,AcOH,100°C,87%.(g)CrO3,AcOH,H2O;KOH,MeOH,reflux;(CH2O)n,(CO2H)2,MeOH,50℃,86%. 22の不斉閉環反応は予想どうりに進行し、93%eeと非常に高い選択性で目的の化合物を得ることが出来た。これより三工程で(-)-エプタゾシンの合成中間体24へと変換することが出来た。さらに文献に従い合成を行い(-)-エプタゾシンの全合成を完了した。 3.逆転写酵素阻害剤(+)-ハレナキノールの触媒的不斉合成 次に私は、不斉Heck反応による不斉四級炭素の構築法の有効性を示すべくさらに複雑な骨格を有する天然物である(+)-ハレナキノールの全合成に着手した。。 (+)-ハレナキノールはDNAポリメレースの 及び 及び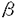 を阻害しない特異的な逆転写酵素阻害剤であるためエイズウイルス等の逆転写酵素を有しているウイルスの抗ウイルス剤として利用しうることが期待されている。さて、(+)-ハレナキノールの逆合成ルートを考えた場合SchemeVのようにナフタレン環を有するトリフレート体29からの不斉Heck反応が鍵工程となることが分かる。 を阻害しない特異的な逆転写酵素阻害剤であるためエイズウイルス等の逆転写酵素を有しているウイルスの抗ウイルス剤として利用しうることが期待されている。さて、(+)-ハレナキノールの逆合成ルートを考えた場合SchemeVのようにナフタレン環を有するトリフレート体29からの不斉Heck反応が鍵工程となることが分かる。  Scheme V Scheme V そこでまず2,3-ジメトキシナフタレンを出発原料として容易に合成可能なナフタレン環にジメトキシ基がない化合物30を用いて不斉閉環反応の検討を行った(SchemeVI)。  Scheme VI Scheme VI この場合にも92%eeと高い選択性で反応が進行することが分かった。そこで、次に(+)-ハレナキノールの合成に直接つなげるためにパラ位にジメトキシ基が存在する化合物の合成を行った。まず6,7-ジメトキシ-1-テトラロン(32)を出発原料とし、途中2回の連続するクロスカップリング反応を行うことにより効率良くトリフレート体(36)を合成することが出来た(Scheme VII)。  Scheme VIIReaction conditions:(a)BBr3,CH2CH2,0℃;BnBr,K2CO3,DMF,60℃,74%.(b)CrO3,AcOH-H2O,0℃;KHMDS,Mel,23℃.54%.(c)H22,Pd/C,EtOAc,23℃;TBDMSCl,Et3N,23℃;Tf2O,Et3N,-78℃-0℃,77%.(d)allyl magnesiumbromide,PdCl2(dppf),Et2O,rt;9-BBN,THF,0℃;17,PdCl2(dppf),K3PO4,THF,50℃,83%.(e)TBAF,THF,0℃;Tf2O,Et3N,CH2Cl2,-78℃-0℃,80%.(f)Pd(0)-(S)BINAP complex(10mol%),K2CO3,THF,60℃,78%(87%ee). Scheme VIIReaction conditions:(a)BBr3,CH2CH2,0℃;BnBr,K2CO3,DMF,60℃,74%.(b)CrO3,AcOH-H2O,0℃;KHMDS,Mel,23℃.54%.(c)H22,Pd/C,EtOAc,23℃;TBDMSCl,Et3N,23℃;Tf2O,Et3N,-78℃-0℃,77%.(d)allyl magnesiumbromide,PdCl2(dppf),Et2O,rt;9-BBN,THF,0℃;17,PdCl2(dppf),K3PO4,THF,50℃,83%.(e)TBAF,THF,0℃;Tf2O,Et3N,CH2Cl2,-78℃-0℃,80%.(f)Pd(0)-(S)BINAP complex(10mol%),K2CO3,THF,60℃,78%(87%ee). 不斉閉環反応を試みたところやはり87%eeと高い不斉収率で目的とする化合物37を得ることに成功した。さらなる変換により、四環性化合物38を合成することに成功した。現在(+)-ハレナキノールの全合成を検討中である。 |
| 審査要旨 | | 不斉点をもつ医薬品を高い光学純度でいかにして合成するかは、大変重要な問題である。今回、鎮痛剤として広く臨床に用いられている(-)-エプタゾシン(1)、(-)-モルヒネ(2)、また特異的な逆転写酵素阻害剤である(+)-ハレナキノール(3)などに共通の構造であるベンジル位の四級炭素を不斉Heck反応により構築する方法論を確立する為の研究を行なった。  図表1.不斉Heck反応の検討 図表1.不斉Heck反応の検討 目的とするベンジル位四級炭素の構築法として、4のような化合物を基質として分子内不斉Heck反応による閉環反応を行い、目的とする不斉四級炭素を有する化合物5を合成する事を計画した。  Scheme I Scheme I まず、(E)-体10及び11に関して閉環条件を詳細に検討した結果、化学収率は90%程度と良好ながら不斉収率は50%ee程度とあまり高い値は得られなかった。これに対し(Z)-体12を用いて同様の反応条件で反応を行った場合、80%eeと高い値が得られた(Table I,run8)。そこでさらなる不斉収率の向上をめざし反応条件の検討を行った結果、Pd(OAc)210mol%、(R)-BINAP20mol%、炭酸カリウム3.0mol eq用いて、THF中50℃で反応を行った場合に化学収率97%,不斉収率91%eeという満足すべき結果が得られる事がわかった。  Table I.Asymmetric Heck Cyclization of Aryl Triflate 10,11,12*2.非麻薬性鎮痛薬(-)-エプタゾシンの触媒的不斉合成 Table I.Asymmetric Heck Cyclization of Aryl Triflate 10,11,12*2.非麻薬性鎮痛薬(-)-エプタゾシンの触媒的不斉合成 以上のように不斉Heck反応を用る事によりベンジル位四級炭素の効率よい不斉合成法を確立することができたので、非麻薬性鎮痛薬である(-)-エプタゾシンの触媒的不斉合成を行なうこととした。(Z)-三置換オレフィン22をScheme IVに示すように立体選択的に合成し、閉環反応を行なった結果、93%eeと非常に高い選択性で目的の化合物を得ることが出来た。これより24をへて(-)-エプタゾシンの全合成を完了した。 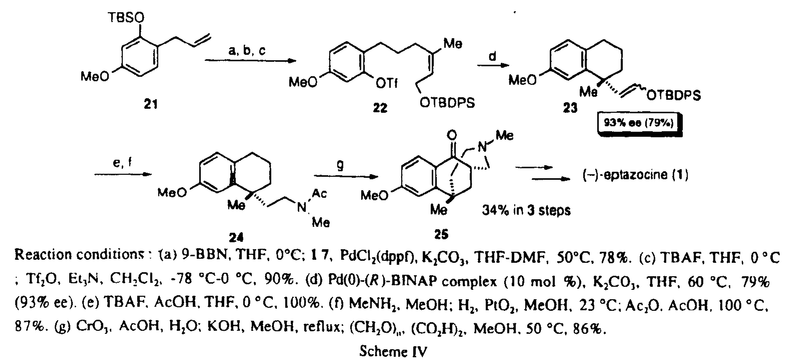 Scheme IVReaction conditions:(a)9-BBN,THF,0℃;17,PdCl2(dppf),K2CO3,THF-DMF,50℃,78%.(c)TBAF,THF,0℃;Tf2O,Et3N,CH2Cl2,-78℃-0℃,90%.(d)Pd(0)-(R)-BINAP complex(10mol%),K2CO3,THF,60℃,79%(93%ee).(e)TBAF,AcOH,THF,0℃,100%.(f)MeNH2,MeOH;H2,PtO2,MeOH,23℃;Ac2O,AcOH,100℃,87%.(g)CrO3,AcOH,H2O;KOH,MeOH,reflux;(CH2O)n,(CO2H)2,MeOH,50℃,86%.3.逆転写酵素阻害剤(+)-ハレナキノールの触媒的不斉合成 Scheme IVReaction conditions:(a)9-BBN,THF,0℃;17,PdCl2(dppf),K2CO3,THF-DMF,50℃,78%.(c)TBAF,THF,0℃;Tf2O,Et3N,CH2Cl2,-78℃-0℃,90%.(d)Pd(0)-(R)-BINAP complex(10mol%),K2CO3,THF,60℃,79%(93%ee).(e)TBAF,AcOH,THF,0℃,100%.(f)MeNH2,MeOH;H2,PtO2,MeOH,23℃;Ac2O,AcOH,100℃,87%.(g)CrO3,AcOH,H2O;KOH,MeOH,reflux;(CH2O)n,(CO2H)2,MeOH,50℃,86%.3.逆転写酵素阻害剤(+)-ハレナキノールの触媒的不斉合成 次に、逆転写酵素阻害剤である(+)-ハレナキノールの全合成も検討した。Scheme VIIに示すように合成した36の不斉閉環反応により87%eeと高い不斉収率で目的とする化合物37を得ることに成功した。さらなる変換により、四環性化合物38へと導いた。  Scheme VIIReaction conditions:(a)BBr3,CH2CH2,0℃;BnBr,K2CO3,DMF,60℃,74%.(b)CrO3,AcOH-H2O,0℃;KHMDS,Mel,23℃,54%.(c)H2,Pd/C,EtOAc,23℃;TBDMSCl;Et3N,23℃;Tf2O,Et3N,-78℃-0℃,77%.(d)allyl magnesiumbromide,PdCl2(dppf),Et2O,rt;9-BBN,THF,0℃;17,PdCl2(dppf),K3PO4,THF,50℃,83%.(e)TBAF,THF,0℃;Tf2O,Et3N,CH2Cl2,-78℃-0℃,80%.(f)Pd(0)-(S)-BINAP complex(10mol%),K2CO3,THF,60℃,78%(87%ee). Scheme VIIReaction conditions:(a)BBr3,CH2CH2,0℃;BnBr,K2CO3,DMF,60℃,74%.(b)CrO3,AcOH-H2O,0℃;KHMDS,Mel,23℃,54%.(c)H2,Pd/C,EtOAc,23℃;TBDMSCl;Et3N,23℃;Tf2O,Et3N,-78℃-0℃,77%.(d)allyl magnesiumbromide,PdCl2(dppf),Et2O,rt;9-BBN,THF,0℃;17,PdCl2(dppf),K3PO4,THF,50℃,83%.(e)TBAF,THF,0℃;Tf2O,Et3N,CH2Cl2,-78℃-0℃,80%.(f)Pd(0)-(S)-BINAP complex(10mol%),K2CO3,THF,60℃,78%(87%ee). 以上、本論文はベンジル位四級炭素の不斉構築法の開発とそれを用いた医薬合成についての高いレベルの研究について記載したものである。よって博士一(薬学)の学位に値すると判定された。 |