(結果と考察) クマリン系抗生物質に耐性でかつts性を示す2株(LE316,RM102)、及びPar表現型(高温で染色体の分離に異常が見られる)を示す2株(W3110gyrB110,W3110gyrB946)について解析を行なった。
1)gyrBts変異株の表現型及び変異部位の解析
gyrBts変異株を高温で培養し細胞をDAPIで染色して調べた結果、4株とも染色体の分離が異常になった。又、変異部位は4株ともN末側のATPase活性に関与する領域にあった。さらに4株とも高温ではin vivoでのスーパーコイリング活性が低下していた。このことから、ts変異株ではATPase活性部位の変異によってDNAジャイレースのスーパーコイリング活性が低下し、DNA複製時のDNAのねじれを充分解消できず、DNAの絡まりが多くなるために、Par表現型を示すと考えられる。
2)gyrBts変異株のGyrBタンパク量についての解析
スーパーコイリング活性が低下する原因については、変異の起きている位置からタンパク質の活性が変化していることが考えられるが、本研究ではタンパク量の変化についても検討を加えた。まず、変異株を高温で培養したときのGyrBタンパク質の量をWestern-blotting法により調べたところ、W3110gyrB110株では低温で培養したときに比べて1/3に減少していたが、他の3株ではほとんど変化がなかった。
DNAジャイレースの合成量については、鋳型となるDNAの超らせん密度に依存することが知られている。つまり、DNAジャイレースのスーパーコイリング活性が低下し、鋳型DNAが弛緩すると合成量が増大するという、自身の活性の低下を相補する機構が存在すると言われている。実際、野生株にクマリン系阻害剤であるノボビオシンを作用させると、スーパーコイリング活性が低下し、GyrBタンパクの合成量は増大することがわかった。これに対して、ts変異株に於てはスーパーコイリング活性が低下しているにも拘わらず、総タンパク量が上昇していない。そこで高温で培養したときの合成量の変化をPulse-label法により調べた。すると、高温では合成量が増大することが示された(Fig.1 lane1,3,5,7)。さらに高温で合成されたGyrBタンパク質の安定性をPulse-chase-label法により調べると、高温では不安定になっていることが明らかとなった(Fig.1 lane3,4,7,8)。従って、細胞内のGyrB総タンパク量が増大しないのは、合成量は上昇するが、不安定であり分解されてしまう為であると考えられる。
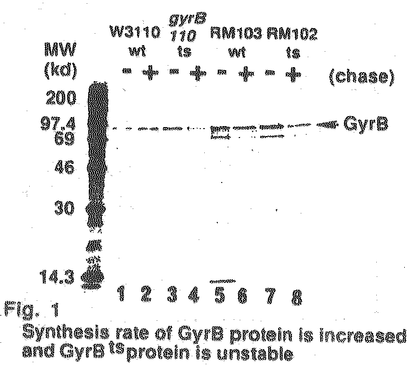 Fig.1Synthesis rate of GyrB protein is increased and GyrBts protein is unstable
Fig.1Synthesis rate of GyrB protein is increased and GyrBts protein is unstable 以上の結果から、変異株がts性を示すのは、変異によりDNAジャイレースの比活性が低下することに加えて、変異GyrBタンパク質の不安定性により比活性の低下を合成量の増加により相補するという調節機構が機能しないためであることが明らかになった。