| 内容要旨 | | 1.緒言 アゴニストおよびアゴニストの作用を増強する薬物(代謝酵素阻害剤など)を臨床応用する上で耐性の発現が問題となっている.これを薬理学的に評価,解析する1つのモデルケースとして, アドレナリン受容体作動薬( アドレナリン受容体作動薬( アゴニスト)の慢性投与に注目した. アゴニスト)の慢性投与に注目した.  アゴニストを生体に慢性的に投与することによって, アゴニストを生体に慢性的に投与することによって, アドレナリン受容体( アドレナリン受容体( AR)を介した作用が減弱することは,in vitroの系,in vivoの系の双方で知られており,心不全の治療に用いられる AR)を介した作用が減弱することは,in vitroの系,in vivoの系の双方で知られており,心不全の治療に用いられる アドレナリン作動性強心薬を長期投与する際の問題点の一つとなっている. アドレナリン作動性強心薬を長期投与する際の問題点の一つとなっている. 多くの哺乳類の心筋ではアドレナリン受容体サブタイプが混在する.例えばラット心筋には 1受容体および 1受容体および 2受容体( 2受容体( 1AR, 1AR, 2AR)が発現しており,このうち 2AR)が発現しており,このうち 1ARは主に陽性変力作用,陽性変時作用に寄与していると考えられている. 1ARは主に陽性変力作用,陽性変時作用に寄与していると考えられている. 2ARおよびその他のアドレナリン受容体サブタイプの心機能に対する役割は耐性発現への寄与を含めて十分明らかではない. 2ARおよびその他のアドレナリン受容体サブタイプの心機能に対する役割は耐性発現への寄与を含めて十分明らかではない. また アゴニストを慢性投与することによる耐性発現の際,心筋 アゴニストを慢性投与することによる耐性発現の際,心筋 ARの減少(down-regulation)も起こることが知られている. ARの減少(down-regulation)も起こることが知られている. ARのdown-regulationは耐性発現の機序であると一般的に考えられている.しかし機能的変化の耐性発現に,量的変化の受容体のdown-regulationがどの程度寄与しているかは現在まで検討されていなかった. ARのdown-regulationは耐性発現の機序であると一般的に考えられている.しかし機能的変化の耐性発現に,量的変化の受容体のdown-regulationがどの程度寄与しているかは現在まで検討されていなかった. 強心薬denopamineのカテコール誘導体であるT-0509(Fig.1)は哺乳類の摘出組織標本で非常に選択的な 1完全アゴニストである.本研究では,T-0509慢性投与によるin vivoでの強心効果への耐性発現と心筋 1完全アゴニストである.本研究では,T-0509慢性投与によるin vivoでの強心効果への耐性発現と心筋 ARサブタイプのdown-regulationを測定し,非選択的な ARサブタイプのdown-regulationを測定し,非選択的な 完全アゴニストのISOと比較することによって, 完全アゴニストのISOと比較することによって, アドレナリン作動性強心薬の耐性発現における アドレナリン作動性強心薬の耐性発現における 1ARサブタイプ選択性の影響を検討した.また 1ARサブタイプ選択性の影響を検討した.また アゴニスト慢性投与により耐性が発現している心筋膜標本と,非可逆的 アゴニスト慢性投与により耐性が発現している心筋膜標本と,非可逆的 AR拮抗薬のbromoacetylalprenololmethane(BAAM)処置によりavailableな受容体を削減した心筋膜標本のadenylatecyclase(AC)活性を比較することにより, AR拮抗薬のbromoacetylalprenololmethane(BAAM)処置によりavailableな受容体を削減した心筋膜標本のadenylatecyclase(AC)活性を比較することにより, AR刺激に対する耐性と心筋 AR刺激に対する耐性と心筋 ARのdown-regulationとの関連を検討した. ARのdown-regulationとの関連を検討した.  Fig.1.The chemical structure of T-05092.in vivoでの耐性発現 Fig.1.The chemical structure of T-05092.in vivoでの耐性発現 T-0509の慢性投与による耐性発現を確認する目的で,慢性投与後のT-0509の心血管作用をin vivoで測定し,ISOの場合と比較した. [方法] 動物は雄性Sprague-Dawley系ラット(7-8週齢,210-320g)を用いた. 浸透圧ポンプをラット皮下に埋め込み薬物を6日間皮下慢性投与した(ISO:2.5-40,T-0509:5-40 g/kg/h,s.c.).ポンプ摘出後,体内の薬物をwash-outさせるために16時間おき,pentobarbital麻酔下に各薬物を累積投与(i.v.)して左心室内圧最大変化率(LVdP/dtmax),心拍数(HR),大腿動脈平均血圧(MAP)の用量作用曲線の変化から耐性発現を評価した.慢性投与期間中のポンプ機能は化学発光法による血漿 g/kg/h,s.c.).ポンプ摘出後,体内の薬物をwash-outさせるために16時間おき,pentobarbital麻酔下に各薬物を累積投与(i.v.)して左心室内圧最大変化率(LVdP/dtmax),心拍数(HR),大腿動脈平均血圧(MAP)の用量作用曲線の変化から耐性発現を評価した.慢性投与期間中のポンプ機能は化学発光法による血漿 アゴニスト濃度の測定で確認した.コントロールとしてsham-operation処置群を採用した. アゴニスト濃度の測定で確認した.コントロールとしてsham-operation処置群を採用した. [結果] コントロール群でのT-0509のED50値(i.v.)はLVdP/dtmax,HR,MAPでそれぞれ24,115,223ng/kgで最大作用は各パラメータでISOの最大作用に匹敵した(Fig.2). ISOのLVdP/dtmaxへの作用(陽性変力作用)は5.0 g/kg/h以上の慢性投与で有意に減少した.T-0509の陽性変力作用は10 g/kg/h以上の慢性投与で有意に減少した.T-0509の陽性変力作用は10 g/kg/h以上の慢性投与で有意に減少した(Fig.2).どちらのアゴニストの場合も慢性投与の用量に依存して陽性変力作用のED50値は増大し,40 g/kg/h以上の慢性投与で有意に減少した(Fig.2).どちらのアゴニストの場合も慢性投与の用量に依存して陽性変力作用のED50値は増大し,40 g/kg/hの投与では4倍になった.このとき最大作用は減少しなかった.ISO慢性投与によるED50値上昇はMAPでも同様に観察されたのに対し,T-0509慢性投与によるED50値上昇はMAPよりLVdP/dtmaxで強くみられた. g/kg/hの投与では4倍になった.このとき最大作用は減少しなかった.ISO慢性投与によるED50値上昇はMAPでも同様に観察されたのに対し,T-0509慢性投与によるED50値上昇はMAPよりLVdP/dtmaxで強くみられた. 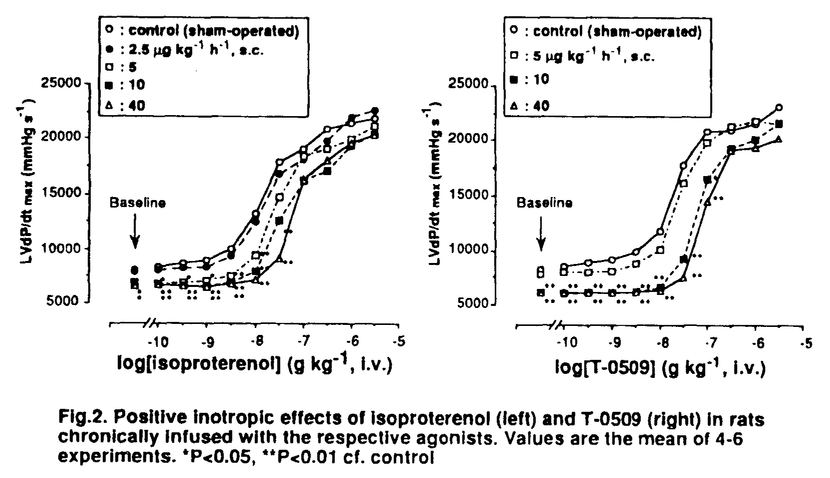 Fig.2.Positive inotropic effects of isoproterenol(left)and T-0509(right)in rats chronically infused with the respective agonists.Values are the mean of 4-6 experiments.*P<0.05,**P<0.01cf.control[小括1] Fig.2.Positive inotropic effects of isoproterenol(left)and T-0509(right)in rats chronically infused with the respective agonists.Values are the mean of 4-6 experiments.*P<0.05,**P<0.01cf.control[小括1] T-0509が 2ARを介する血圧よりも 2ARを介する血圧よりも 1ARを介する心筋収縮力に選択的な作用をもつこと,および最大作用がISOの最大作用に匹敵することからT-0509はwhole animalのレベルで選択的 1ARを介する心筋収縮力に選択的な作用をもつこと,および最大作用がISOの最大作用に匹敵することからT-0509はwhole animalのレベルで選択的 1完全アゴニストであること, 1完全アゴニストであること, 1完全アゴニストの慢性投与によっても心筋収縮力増強作用に耐性が発現することが示唆された.T-0509の心収縮力増強作用の減弱の程度は血圧低下作用の減弱より強かったことから,耐性の発現はアゴニストの選択性に依存していることが示唆された. 1完全アゴニストの慢性投与によっても心筋収縮力増強作用に耐性が発現することが示唆された.T-0509の心収縮力増強作用の減弱の程度は血圧低下作用の減弱より強かったことから,耐性の発現はアゴニストの選択性に依存していることが示唆された. 3.心室筋膜標本レベルでの検討  アゴニスト慢性投与による心筋 アゴニスト慢性投与による心筋 ARのdown-regulationおよび心室筋膜標本レベルでの耐性発現をそれぞれ受容体結合実験,AC活性測定により評価し,受容体のdown-regulationの耐性への寄与を検討した. ARのdown-regulationおよび心室筋膜標本レベルでの耐性発現をそれぞれ受容体結合実験,AC活性測定により評価し,受容体のdown-regulationの耐性への寄与を検討した. [方法] 動物は雄性Sprague-Dawlcy系ラット(7-8週齢,210-320g)を用いた. 浸透圧ポンプをラット皮下に埋め込み薬物を6日間皮下慢性投与した(ISO:40,T-0509:40 g/kg/h,s.c.).コントロールとしてsham-operation処置群を採用した.慢性投与後にpentobarbital麻酔下,心臓を摘出し,左心室筋膜標本を調製した.心筋膜標本を用いて,受容体結合実験による g/kg/h,s.c.).コントロールとしてsham-operation処置群を採用した.慢性投与後にpentobarbital麻酔下,心臓を摘出し,左心室筋膜標本を調製した.心筋膜標本を用いて,受容体結合実験による AR量測定とAC活性測定を行った.受容体結合実験のラジオリガンドとして[125I]iodocyanopindolol([125I]CYP), AR量測定とAC活性測定を行った.受容体結合実験のラジオリガンドとして[125I]iodocyanopindolol([125I]CYP), 1と 1と 2ARの存在比を求めるために 2ARの存在比を求めるために 1ARアンタゴニストのCGP20712A(300nM)を使用した.AC活性測定は[ 1ARアンタゴニストのCGP20712A(300nM)を使用した.AC活性測定は[ -32P]ATPより生成したcAMP量をカラム法によって精製することで行った. -32P]ATPより生成したcAMP量をカラム法によって精製することで行った. ARを介したAC活性化作用の ARを介したAC活性化作用の アゴニスト慢性投与による低下と アゴニスト慢性投与による低下と ARのdown-regulationとの関連を調べる目的で,コントロール群の膜標本を100nM BAAM(0℃,1h)で前処置した場合の膜標本の ARのdown-regulationとの関連を調べる目的で,コントロール群の膜標本を100nM BAAM(0℃,1h)で前処置した場合の膜標本の AR量とadenylate cyclase活性を測定した.また, AR量とadenylate cyclase活性を測定した.また, アゴニスト慢性投与による心筋G蛋白質量の変化を測定する目的で,G蛋白質 アゴニスト慢性投与による心筋G蛋白質量の変化を測定する目的で,G蛋白質 サブユニットに対する抗体を用いて心筋膜標本のimmunoblottingを行った.抗 サブユニットに対する抗体を用いて心筋膜標本のimmunoblottingを行った.抗 抗体としてUI-2,抗 抗体としてUI-2,抗 抗体としてUI-1を用い,UI-2によって検出された45kDaのバンドを 抗体としてUI-1を用い,UI-2によって検出された45kDaのバンドを ,UI-1によって検出された41kDaのバンドを ,UI-1によって検出された41kDaのバンドを との結合によるものとし,バンドの密度を定量した. との結合によるものとし,バンドの密度を定量した. [結果] 飽和結合実験より心室筋 1, 1, 2ARはISO慢性投与でそれぞれ22%,63%減少,T-0509慢性投与でそれぞれ26%,32%減少することが明らかとなった.アゴニスト慢性投与によりAC活性ののベースラインは低下する傾向を示した(Fig.3).ISOのAC活性化作用の最大作用がISO,T-0509の慢性投与により,それぞれ55%,53%低下した(Fig.3).このときEC50値は変化しなかった.Forskolin(100 2ARはISO慢性投与でそれぞれ22%,63%減少,T-0509慢性投与でそれぞれ26%,32%減少することが明らかとなった.アゴニスト慢性投与によりAC活性ののベースラインは低下する傾向を示した(Fig.3).ISOのAC活性化作用の最大作用がISO,T-0509の慢性投与により,それぞれ55%,53%低下した(Fig.3).このときEC50値は変化しなかった.Forskolin(100 M)のAC活性化作用は M)のAC活性化作用は アゴニスト慢性投与により減少する傾向を示した.BAAM前処置は[125I]CYPの膜標本への親和性に変化を与えることなく アゴニスト慢性投与により減少する傾向を示した.BAAM前処置は[125I]CYPの膜標本への親和性に変化を与えることなく 1, 1, 2ARへの結合量をそれぞれ27%,40%減少させ,ISOのACへの最大作用を34%減少させた(Fig.3).Forskolin(100 2ARへの結合量をそれぞれ27%,40%減少させ,ISOのACへの最大作用を34%減少させた(Fig.3).Forskolin(100 M)のAC活性化作用にはBAAM処置による変化はみられなかった. M)のAC活性化作用にはBAAM処置による変化はみられなかった. アゴニスト慢性投与によって アゴニスト慢性投与によって 量に変化はみられなかったが, 量に変化はみられなかったが, 量は減少傾向がみられた. 量は減少傾向がみられた.  Fig.3.Effects of prolonged infusion of Fig.3.Effects of prolonged infusion of  agonists(left)and BAAM treatment(right)on isoproterenol-stimulated adenylate cyclase activity of rat left ventricular membranes.Values are the mean of 2 or 3 experiments.[小括2] agonists(left)and BAAM treatment(right)on isoproterenol-stimulated adenylate cyclase activity of rat left ventricular membranes.Values are the mean of 2 or 3 experiments.[小括2] T-0509の慢性投与によって心室筋 1, 1, 2ARはともに約30%減少したのに対し,ISO慢性投与では, 2ARはともに約30%減少したのに対し,ISO慢性投与では, 2ARの減少が顕著であった.これは心筋 2ARの減少が顕著であった.これは心筋 2ARがアゴニストによってよりdown-regulateされやすいか,アゴニストの受容体レベルでのpotencyがwhole animalレベルでのpotencyとは異なっている可能性を示している. 2ARがアゴニストによってよりdown-regulateされやすいか,アゴニストの受容体レベルでのpotencyがwhole animalレベルでのpotencyとは異なっている可能性を示している. BAAM処置による ARサブタイプの減少パターンはT-0509慢性投与の場合と類似していた.BAAMを用いた実験よりT-0509慢性投与による心筋 ARサブタイプの減少パターンはT-0509慢性投与の場合と類似していた.BAAMを用いた実験よりT-0509慢性投与による心筋 ARを介したAC活性上昇の減弱には ARを介したAC活性上昇の減弱には ARのdown-regulationだけではなく他のメカニズムも関与していることが示唆された. ARのdown-regulationだけではなく他のメカニズムも関与していることが示唆された. ARのdown-regulation以外のメカニズムの可能性としてとして ARのdown-regulation以外のメカニズムの可能性としてとして の減少およびACの活性低下も考えられる. の減少およびACの活性低下も考えられる. 4.培養細胞を用いたT-0509の薬理学的性状解析 ISOおよびT-0509の受容体レベルでの選択性を検討する目的で, ARサブタイプを発現させた培養細胞を用いて,各 ARサブタイプを発現させた培養細胞を用いて,各 アゴニストの アゴニストの ARサブタイプに対する親和性(Ki値)と ARサブタイプに対する親和性(Ki値)と ARを介したAC活性化作用のpotency(EC50値)およびefficacy(内活性)を測定した. ARを介したAC活性化作用のpotency(EC50値)およびefficacy(内活性)を測定した. [方法]  ARサブタイプを一過性に発現させたCOS-7細胞の膜標本を用いてGTP(100 ARサブタイプを一過性に発現させたCOS-7細胞の膜標本を用いてGTP(100 M)存在下に[125I]CYPと各 M)存在下に[125I]CYPと各 アゴニストの結合阻害実験を行い,各受容体に対する アゴニストの結合阻害実験を行い,各受容体に対する アゴニストのKi値を求めた. アゴニストのKi値を求めた. 1または 1または 2ARを安定に発現しているCHO細胞の膜標本を用いて,各 2ARを安定に発現しているCHO細胞の膜標本を用いて,各 アゴニストのAC活性化作用のEC50値および内活性を測定した. アゴニストのAC活性化作用のEC50値および内活性を測定した. [結果] COS-7細胞に発現した 1, 1, 2, 2, 3ARに対するISOのKi値はそれぞれ268,378,7475nMであり,T-0509のKi値はそれぞれ237,2680,23000nMであった.CHO細胞に発現した 3ARに対するISOのKi値はそれぞれ268,378,7475nMであり,T-0509のKi値はそれぞれ237,2680,23000nMであった.CHO細胞に発現した 1, 1, 2ARを介したAC活性化作用のEC50値はISOの場合それぞれ40.9,4.8nMであり,T-0509の場合は24.8,46.7nMであった.ISOによる 2ARを介したAC活性化作用のEC50値はISOの場合それぞれ40.9,4.8nMであり,T-0509の場合は24.8,46.7nMであった.ISOによる 1, 1, 2ARを介したACの活性化作用の最大値を基準とした場合,T-0509の内活性は 2ARを介したACの活性化作用の最大値を基準とした場合,T-0509の内活性は 1, 1, 2ARに対してそれぞれ85%,96%であった. 2ARに対してそれぞれ85%,96%であった. [小括3] ISOは 1, 1, 2ARに同等の高い親和性をもち,T-0509は 2ARに同等の高い親和性をもち,T-0509は 1ARのみに高い親和性をもつことが明らかとなった.しかし,AC活性化作用のレベルではISOは選択的 1ARのみに高い親和性をもつことが明らかとなった.しかし,AC活性化作用のレベルではISOは選択的 2完全アゴニストであり,T-0509が非選択的 2完全アゴニストであり,T-0509が非選択的 完全アゴニストであることが明らかとなった.これは慢性投与による心筋での 完全アゴニストであることが明らかとなった.これは慢性投与による心筋での ARのdown-regulationのパターンと一致する. ARのdown-regulationのパターンと一致する. 5.まとめ 本研究により選択的 1アゴニストの慢性投与によっても心筋への作用に耐性が発現することが明らかとなった.また 1アゴニストの慢性投与によっても心筋への作用に耐性が発現することが明らかとなった.また アゴニスト慢性投与の場合とBAAM処置によってavailableな受容体を削減した場合とを比較することで, アゴニスト慢性投与の場合とBAAM処置によってavailableな受容体を削減した場合とを比較することで, アゴニストへの耐性発現に対する アゴニストへの耐性発現に対する ARのdown-regulationの寄与をはじめて評価し, ARのdown-regulationの寄与をはじめて評価し, 1アゴニスト慢性投与による耐性発現は 1アゴニスト慢性投与による耐性発現は ARのdown-regulationだけでは説明できないことを示した.さらに ARのdown-regulationだけでは説明できないことを示した.さらに アゴニスト慢性投与による アゴニスト慢性投与による ARサブタイプ間のdown-regulationの差は ARサブタイプ間のdown-regulationの差は AR-ACレベルでの AR-ACレベルでの アゴニストのpotencyの差に依存している可能性を示した. アゴニストのpotencyの差に依存している可能性を示した. |
| 審査要旨 | | 心不全など循環器系疾患では心臓に共存する アドレナリン受容体サブタイプを介する反応性が選択的に低下していることが知られているが,その機序は必ずしもよく分かっていない.一方, アドレナリン受容体サブタイプを介する反応性が選択的に低下していることが知られているが,その機序は必ずしもよく分かっていない.一方, 1アドレナリン受容体の部分活性薬は心不全の治療に用いられている. 1アドレナリン受容体の部分活性薬は心不全の治療に用いられている.  受容体刺激はもともと生体に備わった強心機序の一つであり,最も自然な形で強心効果をもたらすが,過度の 受容体刺激はもともと生体に備わった強心機序の一つであり,最も自然な形で強心効果をもたらすが,過度の 受容体刺激によってその作用に耐性が発現することが知られている.耐性の発現はカテコラミンのみならず,他のアゴニストもしくはアゴニストの働きを増強するような薬物を治療薬として長期に適用する場合の共通した問題点であり,その機構の解明はアゴニスト作用を持つ新しい治療薬の開発の重要な足がかりとなる. 受容体刺激によってその作用に耐性が発現することが知られている.耐性の発現はカテコラミンのみならず,他のアゴニストもしくはアゴニストの働きを増強するような薬物を治療薬として長期に適用する場合の共通した問題点であり,その機構の解明はアゴニスト作用を持つ新しい治療薬の開発の重要な足がかりとなる. カテコラミンを長期投与することによりその心筋作用に対する耐性が発現した場合,心筋細胞膜の 受容体の減少,すなわちdown-regulationも起こることが知られている. 受容体の減少,すなわちdown-regulationも起こることが知られている. 受容体のdown-regulationは耐性発現の機序の一つと一般的に考えられているが,耐性に対する寄与を定量的に評価した例は現在まで報告されていない. 受容体のdown-regulationは耐性発現の機序の一つと一般的に考えられているが,耐性に対する寄与を定量的に評価した例は現在まで報告されていない. 本論文は選択的 1アドレナリン受容体完全アゴニストT-0509を用いて, 1アドレナリン受容体完全アゴニストT-0509を用いて, アドレナリン作動性強心薬の慢性投与による強心効果への耐性発現と心筋 アドレナリン作動性強心薬の慢性投与による強心効果への耐性発現と心筋 受容体のdown-regulationの関連について新しい薬理学的な手法を用いて研究したものである. 受容体のdown-regulationの関連について新しい薬理学的な手法を用いて研究したものである. 第1章においてT-0509の慢性投与による心収縮力増加作用に対する耐性発現の用量依存性をin vivoで評価し,選択的 1アドレナリン受容体完全アゴニストの慢性投与によって最終的な作用としての強心作用に耐性が発現することをはじめて明らかにしている.また,本研究で用いたin vivoの評価系は,これまでになく低い用量でのアゴニストの慢性投与による耐性も検出可能な,非常に感度が高い有用な系であることを示している. 1アドレナリン受容体完全アゴニストの慢性投与によって最終的な作用としての強心作用に耐性が発現することをはじめて明らかにしている.また,本研究で用いたin vivoの評価系は,これまでになく低い用量でのアゴニストの慢性投与による耐性も検出可能な,非常に感度が高い有用な系であることを示している. 次に第2章では,心筋膜レベルでのT-0509の慢性投与による耐性発現に対する 受容体down-regulationの寄与をadenylate cyclase測定と受容体結合実験から評価し,耐性発現は 受容体down-regulationの寄与をadenylate cyclase測定と受容体結合実験から評価し,耐性発現は 受容体down-regulationだけでは説明できないことを見いだした.この際,受容体down-regulationと類似した状態の膜標本を非可逆的 受容体down-regulationだけでは説明できないことを見いだした.この際,受容体down-regulationと類似した状態の膜標本を非可逆的 受容体遮断薬を用いて作製し,そのadenylate cyclase活性をアゴニスト慢性投与した標本における活性と対比した点は独創性が高い.またin vivoで非選択的 受容体遮断薬を用いて作製し,そのadenylate cyclase活性をアゴニスト慢性投与した標本における活性と対比した点は独創性が高い.またin vivoで非選択的 アゴニストであるisoproterenolの慢性投与により心筋 アゴニストであるisoproterenolの慢性投与により心筋 2受容体の比較的選択的なdown-regulationが起こり,in vivoで選択的 2受容体の比較的選択的なdown-regulationが起こり,in vivoで選択的 1アゴニストであるT-0509の慢性投与により心筋 1アゴニストであるT-0509の慢性投与により心筋 受容体のサブタイプに非選択的なdown-regulationが起こることを見いだした.このことは,各アゴニストの作用のpotencyがin vivoとin vitroの検出系で異なっている可能性を示すものである. 受容体のサブタイプに非選択的なdown-regulationが起こることを見いだした.このことは,各アゴニストの作用のpotencyがin vivoとin vitroの検出系で異なっている可能性を示すものである. この可能性を確認するため,第3章では各 受容体サブタイプを大量に発現させた培養細胞を用いてin vitroの系でのアゴニストの選択性をadenylate cyclase活性化能を指標に検討している.その結果in vitroではisoproterenolは選択的 受容体サブタイプを大量に発現させた培養細胞を用いてin vitroの系でのアゴニストの選択性をadenylate cyclase活性化能を指標に検討している.その結果in vitroではisoproterenolは選択的 2アゴニストであり,T-0509が非選択的 2アゴニストであり,T-0509が非選択的 アゴニストであることを明らかにし, アゴニストであることを明らかにし, アゴニスト慢性投与による心筋 アゴニスト慢性投与による心筋 受容体サブタイプ間のdown-regulationの差は 受容体サブタイプ間のdown-regulationの差は 受容体-adenylate cyclaseレベルでの 受容体-adenylate cyclaseレベルでの アゴニストのpotencyに依存する可能性があることを示している. アゴニストのpotencyに依存する可能性があることを示している. 以上,本研究は 1完全アゴニストの慢性投与によりin vivoでの心筋作用に耐性が発現することをはじめて明らかにし,心筋の耐性発現における 1完全アゴニストの慢性投与によりin vivoでの心筋作用に耐性が発現することをはじめて明らかにし,心筋の耐性発現における 受容体down-regulationの寄与の度合いをはじめて評価した点,また検出する機能の差により 受容体down-regulationの寄与の度合いをはじめて評価した点,また検出する機能の差により アゴニストの選択性がずれる可能性を示した点など循環薬理のみならず一般的な薬理学の発展にも寄与するものであり,博士(薬学)の学位を授与するに値するものと認めた. アゴニストの選択性がずれる可能性を示した点など循環薬理のみならず一般的な薬理学の発展にも寄与するものであり,博士(薬学)の学位を授与するに値するものと認めた. |