学位論文要旨
| No | 111430 | |
| 著者(漢字) | 光本,篤史 | |
| 著者(英字) | ||
| 著者(カナ) | ミツモト,アツシ | |
| 標題(和) | パラコート類縁化合物の酸化還元特性に関する検討 | |
| 標題(洋) | ||
| 報告番号 | 111430 | |
| 報告番号 | 甲11430 | |
| 学位授与日 | 1995.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 博薬第725号 | |
| 研究科 | 薬学系研究科 | |
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 除草剤で知られるパラコートは生体内で1電子還元された後、酸化還元サイクルによって酸素に電子を渡す。このとき生成するスーパーオキサイド及びそこから派生する活性酸素種が生体に対し障害を与える。活性酸素増産作用を示す化合物はパラコートのほかにも抗癌剤ブレオマイシンやキノン系抗菌剤など有用な化合物が多い。そこでパラコートの構造を規範とした種々の化合物を合成し、それらの酸化還元電位と活性酸素増産作用および生物活性との関わりについて検討した。 MPP+は、MPTP発症パーキンソニズムの活性代謝物として知られる化合物であるが、その構造がパラコートに類似していることから酸化還元サイクルによる活性酸素生成が可能な候補化合物と考えられた。そのため活性の強弱は酸化還元電位との相関が考えられ、この点を明らかにすることを目的としてMPP+のフェニル基に置換基を導入し、それぞれの酸化還元電位と活性酸素増産能との関連および大腸菌に対する効果について検討した。 合成した10種のMPP+誘導体について酸化還元電位を測定したところ-860mVから1335mVまでの広がりを持つ事が分かった(Table 1)。これらの化合物を用いてCyt.c法によるスーパーオキサイド産生能を検討したところ化合物1、2、3に活性が見られた。これは化合物の酸化還元電位と良い相関があり、電子吸引性の置換基を導入することにより活性酸素産生能を発現させることが出来た。  またこれらの化合物を用いて好気的条件下および嫌気的条件下大腸菌の生育について検討した。その結果、化合物1は濃度依存的に増殖阻害効果を示した(Fig.1)。この効果は酸素依存的だった。一方、化合物2、4の増殖阻害効果は酸素非依存的であった。さらに大腸菌の致死に対する効果を検討したところ、化合物2、4には見られたが化合物1には見られなかった。  以上のことから酸化還元不活性な骨格に電子吸引性の置換基を導入することによって、酸化還元電位をプラス側へ変化させ新たな活性酸素増産剤4’-NO2MPP+を見いだすことができた。 パラコートの骨格を保持したままその脂溶性を変化させることにより、細胞内での挙動が変化し、その酸素毒性に質的な違いが見いだせるのではないかと考えた。そこでパラコートの一方のメチル基を直鎖アルキル基で置換し、その酸化還元特性と大腸菌に対する効果について検討した。 パラコートの持つ2つのメチル基のうち一方のアルキル鎖が1から10までの直鎖アルキル基を持つ誘導体C1Cnを合成した(Fig.2)。 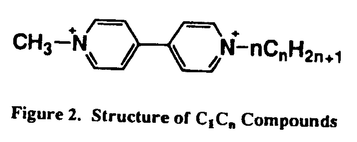 これらの化合物の酸化還元電位を測定したところ、パラコートとほぼ同様の酸化還元電位を示した。このことからこれらの化合物は細胞内で同様の酸化還元特性を示すことが示唆された。 大腸菌を還元系とするCyt.c法を用いてスーパーオキサイド産生能を検討したところ等濃度ではアルキル鎖が長くなるに従って活性が高くなった。このことは酸化還元特性の同じ化合物でも、脂溶性の違いが膜の透過性に反映し、細胞外のスーパーオキサイド産生能に差異をもたらすと考えられた(Fig.3)。  次に好気的条件下大腸菌の増殖に対する影響を検討したところ、アルキル基の長さの違いによって、3相性を示した。C1C1-C1C4にかけては長さに応じて活性は強くなり、C1C4-C1C6が同程度、C1C7-C1C10にかけては活性が弱まっていった。嫌気的条件下同様の検討をしたところ、C1C1-C1C7は阻害活性を示さなかったのに対し、C1C8-C1C10では高濃度で阻害活性を示した。これらの結果からいずれの化合物も酸素依存的な活性を持つことが明らかとなり、アルキル鎖が中程度のものまではその活性が上昇することが分かった。細胞外でのスーパーオキサイド産生量とは必ずしも相関がなく、このことは脂溶性が増すことによって細胞内濃度が増せば酸素毒性は増強されるが、細胞外で多くの活性酸素を産生しても大腸薗の増殖には影響を与えないことが分かった。また、アルキル鎖の長いものでは酸素非依存的な活性を示すようになった。嫌気的条件で増殖阻害活性が見られたときに培養液の濁りが消える現象が観察されたことから、酸素非依存的な活性は界面活性様作用が現われたのではないかと考えられる。 さらに致死実験を行ったところ、増殖阻害実験とは異なる結果を示した。C1C1-C1C4にかけては長さに応じて致死活性は弱くなり、C1C4-C1C6は活性がほとんどなく、C1C7-C1C10にかけては活性が極端に強まっていった。この結果は、アルキル鎖を長くすることによって膜の透過性を増した化合物は、その酸素依存的な活性を致死実験では反映することが出来ないことを明らかにした。このことは増殖阻害実験と致死実験における操作法の違いが関与しているのではないかと考えられた。即ち増殖阻害実験では化合物は常に培養液中に存在するのに対し、致死実験に於ては希釈操作等により、細胞内に一端取り込まれた化合物が細胞外へ漏出することが考えられた。またC1C7以上の長さを持つ化合物で致死活性が増大したことは、致死実験では高濃度で化合物を用いることと合わせ考えて、酸素非依存的な活性が細胞と接触している短時間のうちに現われたものと推察している。 種々の酸化還元反応において化合物の酸化還元電位は重要な要因であるが、酸化還元特性を示す化合物に対し、タンパク質はどのような影響を与えるのか興味がもたれた。そこで、抗パラコート抗体を調製し、タンパク質による認識が酸化還元電位に与える影響を検討した。ハプテン抗原としてパラコート骨格を含みかつ平面性を持つような化合物を選んだ(Fig.4)。パラコートは2つの芳香環をつなぐ結合で自由回転可能であるが、その回転を平面に固定することで、還元され易くなると考えた。  常法に従いパラコートを認識するモノクローナル抗体を調製し、3種のIgGと2種のIgMを得た。3種のIgG(MA1G,MF1G,MB2G)についてパラコート類縁化合物を用いた結合阻害実験を行い、モノクローナル抗体の認識様式を検討した。その結果、MA1Gは化合物のジカチオン性を強く認識し、MF1GとMB2Gはモノカチオン性と平面性を認識していることが分かった(Table 2)。  diquat(DQ2+;E1/2=-365mV)とmethylbenzylviologen(MBzV2+;E1/2=-387mV)を用いて酸化還元滴定を行い、モノクローナル抗体の効果を検討した。対照としてBSAの存在下およびBSAに共有結合させたviologenを用い滴定を行ったところ、タンパクの効果はほとんど見られなかった。しかしパラコートを特異的に認識するモノクローナル抗体の存在下検討したところ、抗体の添加量に従いdithioniteによるMBzV2+の還元量が減少した。このことはMBzVが抗体とcomplexを形成することによりdithioniteでは還元されないほど酸化還元電位がマイナス側へ変化したものと推察される。この原因は当初予想した平面性の認識よりも静電的相互作用が強く、化合物の電子的影響を変化させることが大きく働いたものと考えている。 | |
| 審査要旨 | 活性酸素増産作用を示す化合物は抗癌剤ブレオマイシンやキノン系抗菌剤など薬剤として有用な化合物が多い。本研究では酸化還元活性を有し,かつ単純な骨格を持つパラコートの構造を規範とした種々の化合物を合成し,それらの酸化還元電位と活性酸素増産作用および生物活性との関わりについて検討した。 MPP+は,MPTP発症パーキンソニズムの活性代謝物として知られる化合物であるが,その構造はパラコートに類似しており,酸化還元サイクルによる活性酸素生成が可能な化合物と考えられ,活性の強弱は酸化還元電位と相関することが予想される。この点を明らかにすることを目的として,10種のMPP+誘導体(Table 1)を合成し,それらについて酸化還元電位,スーパーオキサイド産生能,スーパーオキサイド依存の生物活性を測定した。その結果,酸化還元不活性な骨格に電子吸引性の置換基を導入することにより,酸化還元電位をプラス側へ変化させた新たな活性酸素増産剤4’-NO2MPP+を見いだした。  パラコートの骨格を保持したままその脂溶性を変化させることにより細胞内での挙動が変化し,結果としてその酸素毒性に質的な違いが生じると考えられる。そこでパラコートの一方のメチル基を直鎖アルキル基で置換し,その酸化還元特性と大腸菌に対する増殖阻害効果について検討した。(Fig.1)。 その結果アルキル基の長さの違いにより3相性を示し,アルキル鎖が中程度のものまでは大腸菌増殖阻害活性が上昇すること(C1C1-C1C4),C1C4-C1C6は同程度であり,さらにアルキル鎖の長いもの(C1C7-C1C10)では酸素非依存的な活性を示した。結果として細胞外でのスーパーオキサイド産生量とは必ずしも相関がなく,細胞内における化合物濃度と毒性の強弱が示された。酸素非依存的活性は界面活性様作用によると考えられた。 酸化還元特性を示す化合物に対し,タンパク質などによる生体中での化合物の環境が電位にどのような影響を与えるのか興味がもたれる。そこで,抗パラコート抗体を調製し,タンパク質による認識が酸化還元電位に与える影響を検討した。ハプテン抗原としてパラコート骨格を含みかっ平面性を持つ化合物を選び(Fig.2),常法に従い調製した結果,3種のIgG(MA1G,MF1G,MB2G)と2種のIgMを得た。3種のIgGモノクローナル抗体間に基質に対し大きな認識様式の違いがあることが明らかになった。また酸化還元反応を行うことによりこれらの抗体による基質に対する認識は基質の平面性よりも静電的認識の方が強く,その効果により化合物の電子的影響を変化させることが示唆された。  以上のように本研究はパラコート類縁化合物を用いてその酸化還元電位と活性酸素増産作用およびその生物活性との相関,およびモノクローナル抗体を用いて酸化還元化合物の生体における環境とその活性の相関について重要な知見をもたらし,医薬化学,生物有機化学両領域にわたる成果として高く評価されるものであり,博士(薬学)の学位を受けるに十分であると認定した。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54482 |