| 内容要旨 | | tRNAが対応するアミノアシル-tRNA合成酵素(aaRS)によって厳密に認識され,正しいアミノ酸を受容することは,遺伝情報の正しい発現のためにきわめて重要である.aaRSが,みな互いによく似たL字型の高次構造を持つ多くのtRNAの中から(図 1),いかに対応するtRNAだけを認識しているのかという,tRNAの分子認識のメカニズムについては,最近,大腸菌の系を中心に解明が進んできた.それによると,一般にtRNA中の比較的少数の塩基あるいは塩基対が認識に関わっていることが明らかになった(アイデンティティー決定因子).大腸菌においては,アンチコドンおよび,3’末端から4番目の塩基(73番目)いわゆる識別位塩基については、特に精力的に研究がなされ,わずかな例外を除いて,両者とも非常に重要な因子となっていることが解明された.また,その他にも、アクセプターステムの端の塩基対や,Dループに存在する塩基が,重要な役割を果たす場合があることもわかってきた。つまり,アイデンティティー決定因子の位置あるいは塩基は、aaRSごとに異なっている. 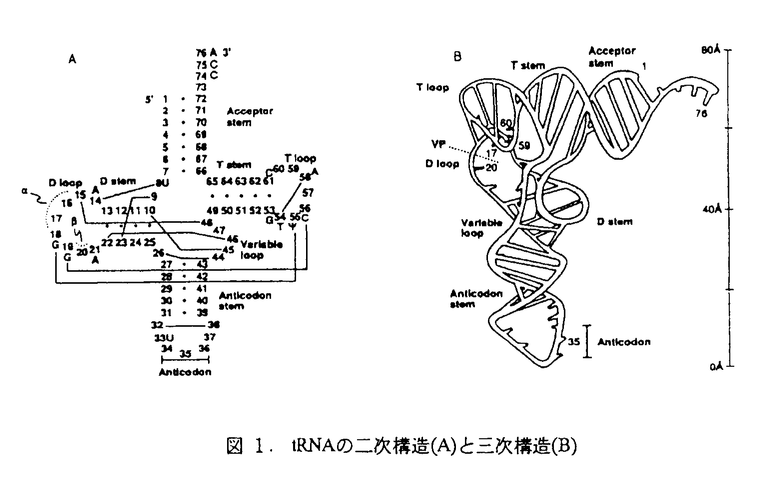 図1.tRNAの二次構造(A)と三次構造(B) 図1.tRNAの二次構造(A)と三次構造(B) それでは,大腸菌のtRNA認識のメカニズムは他の生物種,すなわち真核生物,あるいは,他の原核生物でも保存されているのであろうか.私は酵母および高度好熱菌の系を中心に,aaRSによるtRNAの認識部位の研究を行い,大腸菌の系の結果と比較することで異種生物間の認識部位の相違と類似性を明らかにし,分子認識の進化について考察した.20種のaaRSは活性部位の構造の違いから2つのclassに等分されるが,研究の対象とした生物種とアミノ酸種は,対応するaaRSがclass IIに分類される,大腸菌のアスパラギン酸tRNA,酵母,高度好熱菌のトレオニンtRNA,酵母,高度好熱菌のヒスチジンtRNA,そして,大腸菌,高度好熱菌,酵母のグリシンtRNAである.方法は,T7RNAポリメラーゼ転写系を用い各種のtRNA変異体を調製し,これらの転写物に対してin vitroでそれぞれのアミノ酸受容活性を反応速度論的に測定した.これによって,それぞれのtRNAの認識部位(アイデンティティー決定因子)を決定する.また,認識部位と同定した塩基を,他のアミノ酸種のtRNAに導入することで目的のアミノ酸を受容できるようにさせtRNAの特異性を変えるいわゆるtRNA switchingを行うことで確認とした. あるaaRSが対応するtRNAを認識するとき,まず考えられることは,認識される塩基が,他の19アミノ酸種のtRNAと異なるなどそのtRNAに特徴的であることが必要だろう.そこで,tRNAの配列解析を行うことにより,酵母,大腸菌において,20アミノ酸種のtRNAそれぞれに特徴的な塩基を調べた.同時に,認識に関わると考えられる機能的な塩基は,進化を通じて保存されているという仮定のもとに,生物種間でそのアミノ酸種のtRNAで保存されている塩基を原核生物間,真核生物間でそれぞれ指摘した.これらの2つの条件を満たす塩基を認識部位の第一候補とし実験を進めた. 大腸菌アスパラギン酸tRNA(tRNAAsp)においては,強い認識部位となっているのはアンチコドン、識別位塩基,C38であった.また,DステムのG10-U25とG2-C71が弱い認識部位となっていた.in vitroでの研究およびX線構造解析がすでに行われている酵母tRNAAspの結果と比べると,認識の強弱が若干異なることを除けば,結果は本質的に共通であった. tRNAThrにおいては,大腸菌と同様に,酵母,好熱菌においても,アンチコドンおよびアクセプターステムの末端の1番目の塩基対(G1-C72)の塩基の変換に対し著しい活性の低下が見られ、認識部位が保存されていることを示した。識別位塩基については,他の多くのアミノ酸種のtRNAと異なり,生物種間で保存されていないことがtRNAThrの特徴の一つである.大腸菌tRNAThrのA73は認識に関わっていない,つまり塩基変換に対して活性の低下が見られないことはすでに報告されていたが,好熱菌のU73,酵母のA73は.塩基変換に対してそれぞれ活性が低下した。また、2番目の塩基対(C2-G71)が,大腸菌では非常に重要な認識部位であったが,酵母,好熱菌では認識に全く関わっていなかった。3番目の塩基対は,全生物種のtRNAThrを通じてPy3-Pu70で保存されているが,3生物種のtRNAThrでいろいろな塩基変換をしたうちG3-U70への変換のみが活性の低下を示した.全生物種を通して,アクセプターステムの第3番目の塩基対にこのG3-U70を持つのはtRNAAlaのみで,この部位はAlaRSの主要な認識部位となっていることが知られている.したがって,tRNAAlaのG3-U70が同時にThrRSにとってのantideterminantとして機能している可能性を示唆している。以上の結果から,tRNAThrにおいては主要な認識部位は保存されているが,アクセプターステム上部の認識のされ方に相違がみられ,進化の過程で認識機構に分岐が生じている可能性を指摘した. 既知のすべての生物種においてtRNAHisは、他のtRNAとは異なり、5’末端が一塩基長いという特徴をもつ。さらに興味深いことに,その塩基G-1とペアをつくる73番目の塩基,識別位塩基は、原核生物においてはCで保存されているのに対して,真核生物ではAで保存されている。実験結果より,-1番目,73番目,アンチコドンが酵母tRNAHisのアイデンティティー決定因子と結論された.大腸菌の場合,-1番目にGが存在する事がアミノアシル化活性に必要不可欠であったが,酵母では必ずしもG-1である必要はなく,-1番目に塩基が存在することが重要であった.識別位塩基については大腸菌では塩基特異的に認識されていたが,酵母では,A73からC,Uへ変換しても,活性に全く影響を与えず,Gへの変換のみ,著しい活性の低下を示した.これは,HisRSは73番目の塩基を塩基特異的に認識してはいないが,そこにG73を持つtRNA種(特にアンチコドンの2文字目が共通なtRNAAspとtRNAAsn)を識別し排除していることを示唆している.大腸菌tRNAHisの識別位塩基C73は,大腸菌の他のアミノ酸種のtRNAには存在しない唯一の塩基であり,識別に大きな役割を果たすことが指摘されていたが,酵母の場合,A73は多くのtRNAに存在している塩基であり,たとえ塩基特異的に強くHisRSが認識したとしても識別には機能せず,他のアミノ酸種のtRNAのA73をも認識することになるので,酵母HisRSがG73のみを排除する機構は意味のあること考えられる.これらの結果は,通常のtRNAより5’端が一つ長い塩基をもつ特徴そのものが,全生物種を通してtRNAHisのアイデンティティー決定因子であることを強く示唆している. tRNAGlyにおいては,3生物種においてアンチコドンが,共通の認識部位であった.識別位塩基は,真性細菌ではU73,真核生物ではA73とそれぞれ保存されているが,塩基が異なって保存されているにも関わらず,共に認識部位となっていた.アクセプターステムの2番目の塩基対(C2-G71)は3生物種で,共通の認識部位となっていた.しかし,1番目の塩基対(G1-C72)は,大腸菌,高熱菌で,3番目の塩基対(G3-C70)は,酵母でそれぞれ認識部位であった.この相違はtRNATrpとの識別と関係していることを指摘することができる.tRNATrpは,真性細菌では,A1-U72で保存されているのでGlyRSが1番目の塩基を認識することは意味のある事である.真核生物では,tRNATrpはG1-C72で保存されているので,酵母のGlyRSが1番目の塩基対をたとえ認識していたとしても,その塩基対はtRNAGlyと同一なので識別に関しては意味をなさない.それに対して,酵母ではtRNATrpとは異なっている3番目の塩基対をGlyRSが認識していることがわかった. 以上の結果をまとめると,まずアンチコドンが認識部位として種を通じて重要であることが明確となった.これはアンチコドン自体,mRNAを介してアミノ酸に対応するので,tRNAアイデンティティーとしてアンチコドンが選ばれたのは能率的なことである.これに対して,生物種によって明らかに認識部位が異なっている場合もあることをこれら実証できた.特に,識別位塩基が,種によって塩基が異なっているにも関わらず,この部位が共通の認識部位となっていたことは,進化上,認識部位の変異を許容する事ができることを示している.この変化が可能である一つの説明として,アンチコドンやtRNAHisのG-1のようにそれだけでそのtRNAアイデンティティーが決まるような認識部位がすでに獲得されている場合,他の認識部位に変異がおきても特異性に変化は起こらないので,変異を許容できると考えることができる.また,生物種間での認識部位の相違は,他のアミノ酸種のtRNAの識別の機構に相違を生じさせていることも指摘した.tRNAの配列からtRNAの認識部位を考えるとき,配列解析で示した塩基,すなわち原核生物あるいは真核生物で保存され,かつ他のアミノ酸種のtRNAとより異なっている塩基は,高い確率を持って認識部位となっていることを実証した. |