学位論文要旨
| No | 111712 | |
| 著者(漢字) | 霜田,靖 | |
| 著者(英字) | Shimoda,Yasushi | |
| 著者(カナ) | シモダ,ヤスシ | |
| 標題(和) | カエル卵ゼリー層酸性糖タンパク質の糖鎖構造と機能 | |
| 標題(洋) | Glycan chain structure and function of anuran egg jelly coat acidic glycoproteins | |
| 報告番号 | 111712 | |
| 報告番号 | 甲11712 | |
| 学位授与日 | 1996.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(理学) | |
| 学位記番号 | 博理第3076号 | |
| 研究科 | 理学系研究科 | |
| 専攻 | 生物化学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 細胞の表層には糖タンパク質および糖脂質のような複合糖質が局在しており、細胞が外界と相互作用を行う場を形成している。その複合糖質の糖鎖と外界からの物質との結合が細胞と外界との相互作用の重要な素過程を構成していることが例証され始めている。カエル卵の場合、卵細胞はゼリー層に覆われており、その主成分が糖に富んだ糖タンパク質であることが以前から知られていた。カエル卵ゼリーは受精の成立に必要であり、その役割として物理的衝撃およびバクテリアの侵入から卵を保護する、多精を防止する、Ca2+を保持する等が知られているが、それらの分子機構は解明されていない。本論文では、ニホンヒキガエルとアフリカツメガエルの卵ゼリー層から主要成分である糖タンパク質を精製し、それらの糖鎖構造と機能の解明を目的として次のことを行った。 (1) カエル卵ゼリー層主要糖タンパク質の単離と糖鎖構造解析 (2) カエル卵ゼリー層糖タンパク質のカルシウムおよび表層顆粒レクチンとの結合性の解析 ニホンヒキガエルおよびアフリカツメガエルの未受精卵ゼリー層を可溶化し、フェノール処理して得られた水層を2-メルカプトエタノールの存在下でWhatman DE52陰イオン交換クロマトグラフィーおよびSephacryl S-500ゲル濾過を行って、主要糖タンパク質B-JGPおよびX-JGP3を得た。二種のカエル卵ゼリー層由来の糖タンパク質は共通して糖含量が高く(約80%)、アミノ酸はSerとThrで約50%を占める。一方、酸性基としてB-JGPはNeuAc残基、X-JGP3は硫酸基に富むことが主な相違点であった。 それぞれの糖タンパク質からO-結合型糖鎖画分を調製するために、25mgのB-JGPおよびX-JGP3をそれぞれ0.1 N NaOH/1 M NaBH4中で37℃,48〜50時間処理した。 OH-/BH4-処理したB-JGPを脱塩後、糖鎖画分をDEAE-Sephadex A-25陰イオン交換力ラムにかけ、中性画分(N)と酸性画分(A)を得た。中性画分はBio-Gel P-4でゲル濾過し、糖鎖画分N-1とN-2を得た。酸性画分はIatrobeadsカラムにかけ、糖鎖画分A-1とA-2を精製した。4つの糖鎖画分について、糖組成分析、メチル化分析、酵素消化、1H-NMRスペクトル測定を行って、以下のように構造を決定した。 OH-/BH4-処理したX-JGP3はBio-Gel P-6でゲル濾過し、得られた糖鎖画分(II)をMono-Q HPLCにかけ、中性画分II-0と酸性画分II-1およびII-2を得た。II-1画分はpreparative TLCによりII-1-1〜II-1-5の5画分に分離した。精製された糖鎖画分II-1-2,II-1-4,II-1-5,II-2の糖鎖構造解析を行った。組成分析の結果、II-2は硫酸基を3個、その他は硫酸基を2個もつO-結合型糖鎖であった。温和メタノリシス処理前後の糖鎖のメチル化分析により、硫酸基の結合位置はGalの3位およびGlcNAcの6位であることが明らかとなり、一次元および二次元1H-NMR測定実験からその結合位置が確認された。それぞれの糖鎖の全体構造はメチル化分析、1H-NMRスペクトル測定、FAB-MS測定により以下のように決定された。 X-JGP3の酸性糖鎖は、硫酸基を2個または3個もつコア2型のO-結合型糖鎖であり、いずれも新規な構造であった。それぞれの糖鎖のGalNAcolの6位に結合する糖鎖構造は、3’,6-二硫酸化N-アセチルラクトサミンまたは3’,6-二硫酸化ルイスX構造と呼ぶべき新しい構造であった。GalNAcolの3位に結合する糖鎖構造は、II-2では3-硫酸化Gal、それ以外の糖鎖では血液型A型構造を共通してもち、そこにGlcNAc B-JGPおよびX-JGP3はいずれもカエル卵ゼリー層の約50%を占める成分であり、ゼリー層の物理化学的性質、および、受精時と初期発生過程における生物学的機能を担う分子であることが推定された。 ニホンヒキガエル卵ゼリー層は受精の成立に必要であるが、受精に必須の成分はCa2+/Mg2+であり、ゼリー層の機能は二価陽イオンを適当な濃度に保持することにあると考えられている。45Caを指標とする透析平衡法によってB-JGPのCa2+結合性を調べた。その結果、B-JGPは濃度依存的にCa2+と結合し、シアリダーゼ処理することでB-JGPのCa2+結合性が失われたことからその結合にはシアル酸残基が必要であることが明らかになった。B-JGPとCa2+との結合性はJGP濃度7〜10mg/mlを境界にして変わることが示唆されので、JGP濃度3mg/mlおよび20mg/mlにおけるCa2+結合性をScatchard分析したところ、3mg/mlのJGP溶液のCa2+結合性は20mg/mlのそれと比較して結合定数は2/3倍、結合部位数は1.5倍であった。淡水中に産み出されるヒキガエル卵ゼリー層中においてB-JGPは28mg/mlから約1/3に希釈されることと考え合わせると、B-JGPのCa2+結合性の変化は受精が成立する自然環境においてB-JGPが高いCa2+結合能をもつしくみが備えられているといえる。アフリカツメガエル卵ゼリー層由来のX-JGP3も同様にCa2+結合性を調べたところ、20mg/mlではB-JGPの5倍の結合定数を示した。これはX-JGP3上の硫酸基がB-JGP上のシアル酸よりもCa2+との親和性が高いことによると考えられる。 アフリカツメガエル卵は受精後、卵膜とゼリー層との間にF-層と呼ばれる層が形成されることが知られている。その層の形成は機械的強度が大きくなることと物質的透過性の変化から多精拒否機構のひとつであること、また、その形成には表層顆粒由来レクチン(CGL)とリガンドとの結合が重要であることが知られている。硫酸化糖タンパク質の組織化学的知見からX-JGP3はゼリー層の最内層のJ1層の主要成分であると考えられ、CGLのリガンド分子であると推定された。そこでELISA法によってCGLとゼリー糖タンパク質との相互作用を調べたところ、X-JGP3はCGLと特異的に結合することがわかった。また、今回アフリカツメガエルから単離したX-JGP3の卵ゼリー糖タンパク質X-JGPO,1,と2はCGLと結合しなかった。X-JGP3は温和メタノリシス処理してもCGLと結合するが、Smith分解によって結合しなくなることから、CGLとの結合にSO42-は必要でなく、末端のFuc残基が必須であることが示唆された。さらにニホンヒキガエルからのB-JGPがCGLと結合することから、CGLが認識する糖鎖構造はFuc | |
| 審査要旨 | 動物卵は卵膜やゼリー層などの卵外被に包まれており、それが受精時に重要な役割を果たすことが知られている。卵外被の主要成分は糖に富んだ糖タンパク質であり、その糖鎖と卵の外または中からの物質との結合が受精の素過程を構成していると認識されている。カエル卵の場合、卵を覆うゼリー層は受精の成立に必要であり、その役割として物理的衝撃およびバクテリアの侵入からの保護、Ca2+保持、多精防止などが知られているが、それらの分子機構は解明されていなかった。本論文では、カエル卵ゼリーの機能を明らかにするためには、ゼリー層の性質の大部分を決定するであろう主要成分を単離して、その構造と機能を調べることが重要であるという観点から、二種のカエル卵ゼリーを材料として、その主要糖タンパク質の構造と機能の解析を行っている。論文は3章からなり、第1章と第2章は二種のカエルの卵ゼリー層主要糖タンパク質の単離と糖鎖構造解析について、第3章は、精製したゼリー層糖タンパク質のCa2+および表層顆粒レクチンとの結合性の解析について述べられている。 序論の研究の背景と意義についての記述に引き続き、第1章ではニホンヒキガエル卵ゼリーを材料とし、第2章ではアフリカツメガエル卵ゼリーを材料として、それぞれの主要糖タンパク質の精製と糖鎖構造解析を行っている。すなわち、二種のカエルの未受精卵ゼリーから主要糖タンパク質(JGP)を精製した後、それぞれの糖鎖構造を組成分析、メチル化分析、酵素消化、1H-NMRスペクトル測定、FAB-MS測定を組み合わせることにより決定している。二種のカエル卵JGPは、糖含量が高く(約80%)、アミノ酸はSerとThrで約50%を占めるという共通の構造的特徴を持つ一方、酸性基としてヒキガエルJGPはNeuAc残基を、アフリカツメガエルJGPは硫酸基をもつという相違点を明らかにしている。ヒキガエルJGPの糖鎖は3〜4糖から成るひ結合型糖鎖であり、NeuAc残基は全てGalNAcolに 二種のカエル卵JGPはいずれもゼリー層の約50%を占める主成分であったことから、JGPはゼリー層の物理化学的性質と生物学的機能を担う分子であると推定し、第3章では、それを実証するとともにその分子機構を解明している。カエル卵ゼリー層は受精の成立に必要であるが、その本質はCa2+/Mg2+を適当な濃度に保持することにあると考えられている。45Caを指標とする透析平衡法によってJGPのCa2+結合性を調べ、二種のJGPはいずれも結合定数〜103M-1でCa2+と結合することを明らかにし、この結合定数はカエルの受精が成立するのに適した二価陽イオン環境を提供する値であることを指摘している。さらに、NeuAc残基または硫酸基を外すことによってJGPのCa2+結合性が失われることを示し、Ca2+との結合にそれらの酸性基が関与していることを明らかにしている。また、アフリカツメガエル卵では、受精後の表層顆粒由来レクチン(CGL)とゼリー最内層との結合による層形成が多精拒否機構のひとつであると考えられている。ELISA法により、JGPがCGLの特異的なリガンドであることを示し、さらに、化学的に部分分解したJGPおよび関連した糖タンパク質を用いることによってCGLが認識する構造をFuc 以上をまとめると、本論文では、まず、JGPを卵ゼリー層から単離して糖鎖構造を決定することによって機能を解析する基盤を確立した。次いで、単離したJGPがゼリー層の機能を担いうることを生化学的な実験によって明らかにし、その分子機構を解明したのである。したがって、本論文の提出者は博士(理学)の学位を受ける資格があるものと認める。 なお、本論文は、北島 健氏、塩川光一郎氏、井上貞子氏、井上康男氏との共同研究であり、既に4編の共著論文として発表(一部は投稿中)されているが、論文提出者が主体となって分析および考察を行ったもので、論文提出者の寄与が十分であると判断する。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54503 |
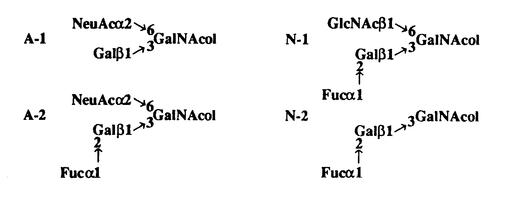

 1→またはFuc
1→またはFuc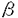 1→3(GlcNAc
1→3(GlcNAc