プロテアーゼは、その触媒基の種類により4つのクラスに分類される。その中でシステインプロテアーゼは、生理学的にきわめて重要な役割を果たしている。したがって、有力なシステインプロテアーゼインヒビターは、標的とするシステインプロテアーゼの生理的役割の解明において有用だと期待される。本論文は、これまで構造的にも機能的にもよく研究されてきたシスタチンスーパーファミリー(CSF)とはあらゆる特性が異なるパイナップルの茎由来のブロメラインインヒビターVI(BI-VI)の構造機能相関に関する研究について述べたもので、六章よりなっている。 第一章においてシステインプロテアーゼインヒビターの現状とその中でのブロメラインインヒビターの位置付けについて概説したのち、第二章ではBI-VIを単離精製し、その一次構造を決定した。BI-VIはゲル濾過およびイオン交換クロマトグラフィーにより精製した。これを過蟻酸酸化し、得られたペプチド鎖をプロテインシークエンサーにより分析しアミノ酸配列を決定した。その結果、BI-VIは軽鎖11残基、重鎖41残基の二本鎖が鎖内および鎖間において5本のS-S結合によって架橋された構造をもつことが判明した。この蛋白質はCSF一般に保存されているGln-Val-Val-Ala-Gly配列を持っておらず、BI-VIは一次構造上、CSFとは異なるシステインプロテアーゼインヒビターであることがわかった。 第三章ではCDおよび二次元NMR法によりBI-VIの二次構造を明らかにした。そしてシステイン残基の位置が互いに似ていることから以前よりその高次構造上でのホモロジーが期待されていたウシ膵臓由来トリプシンインヒビターとの二次構造上での比較を行い、両者間にはホモロジーがないことを明らかにした。 BI-VIはシステインプロテアーゼのみならず、セリンプロテアーゼであるトリプシンやキモトリプシンも若干阻害するという非常に興味深い性質をもつことが、本研究によって明らかとなった。第四章では二次元NMR法によりBI-VIの三次構造を決定し、ダイズ由来ボーマンバーク型トリプシン・キモトリプシンインヒビター(BBI-I)と三次元構造のフォールディングパターンと似ていることを明らかにした。BI-VIの溶液構造の主な特徴は、Aドメイン(重鎖9-29残基)そしてBドメイン(重鎖1-7、31-41残基および軽鎖)の2つからなるドメイン構造をとっていることである。それぞれのドメインは3本のストランドで構成される逆平行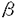 シート構造から構成されている。 シート構造から構成されている。 またBI-VIの阻害活性の至適pHは3〜4で、アルカリ性になるに従ってその阻害活性は減少し、pH8では活性がない。この事実と上記のpH範囲でのCDスペクトルの解析結果から、この阻害活性低下は変性などの構造変化によるものではなく、その表面の電荷分布の変化によるものと判断し、第五章ではBI-VIの解離基のpK値を二次元NMR法により決定した。重鎖1および2位のグルタミン酸、ならびに9および32位のアスパラギン酸のpK値は溶媒に露出している場合の通常の値より約1小さかったが、その他の解離基は通常の値とほとんど変わりがなかった。BI-VIの阻害活性のpH依存性を考えると、pH4.6〜6.2の範囲でもプロトン化しているカルボキシル基が阻害活性に関与していると思われる。このような側鎖カルボキシル基は軽鎖5位のグルタミン酸に絞られた。実際この側鎖のまわりには疎水性残基の側鎖が存在しており、この側鎖が電荷を持つと阻害活性に影響を与えるのかもしれない。以上のことを考えると、この残基の存在する領域はプロテアーゼとの結合領域であると考えられる。 本研究で得られた結果について、第六章において総合的な考察を行っている。 以上本論文は、BI-VIを単離精製して溶液中の立体構造を決定し、構造機能相関について論じたもので学術上極めて価値が高い。よって論文提出者 秦野賢一は、東京大学博士(理学)の学位を受けるに十分な資格があるものと認める。なお本文中の内容の一部については論文として公表済みであり、他の部分も論文として公表予定である。すべて共著論文であるが、論文提出者はその全てにおいて研究の主要部分に寄与したものであることを確認した。 |