生命現象を維持するため、細胞は数多くの化学反応を行っているが、このような化学反応のほとんどすべてを触媒する分子が酵素蛋白質であり、この蛋白質もまた、分子複合体リボソームを中心とする細胞内蛋白質合成系で合成される化合物である。アミノ酸がアミド結合によって重合した高分子である蛋白質は、アミノ酸が決められた順序で配列し、L-体のみの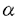 -炭素から構成される一定の分子鎖をもつ点で、現在の工業高分子にはみられない特徴を持つ。また蛋白質合成反応自体、アミド結合形成のような脱水縮合反応が細胞内という水溶液環境で生じるという特徴を持つ。そのため、細胞内における蛋白質合成系を模倣したり人工的に改良することによって、安定で効率のよい蛋白質合成系を創製すれば、それは高分子有機合成化学に新たな展開をもたらす可能性が大きい。 -炭素から構成される一定の分子鎖をもつ点で、現在の工業高分子にはみられない特徴を持つ。また蛋白質合成反応自体、アミド結合形成のような脱水縮合反応が細胞内という水溶液環境で生じるという特徴を持つ。そのため、細胞内における蛋白質合成系を模倣したり人工的に改良することによって、安定で効率のよい蛋白質合成系を創製すれば、それは高分子有機合成化学に新たな展開をもたらす可能性が大きい。 このような新規蛋白質合成系の創製をめざして、申請者の研究室では単純化された蛋白質合成系の開発に取り組んでいる。その過程で、芳香族三級アミン存在下ではリボソーム、アミノアシル-tRNA、mRNA、金属塩、50%〜60%ピリジンだけあれば、従来の合成系では必須であった可溶性蛋白因子やATP、GTPなどのエネルギーが不要な、単純なシステムでペプチド合成が進行することが、バクテリアのリボソーム系で見出された。 本論文は、このようにバクテリアのリボソームで開発された三級アミンを含むペプチド合成系が、他の生物が用いている蛋白質合成系にも適用できるかを、真核生物の酵母と細胞内小器官(オルガネラ)であるウシ・ミトコンドリアの系で検討したものであり、7章から構成されている。第1章は序論で、本研究の背景を述べている。第2章は大腸菌(E.coli)、好熱菌(T.thermophilus)、酵母(S.cerevisiae)およびウシ・ミトコンドリアからリボソームをはじめとする蛋白質合成反応に必要なさまざまな因子の調製方法に関して述べている。 第3章「三級アミン存在下におけるさまざまな生物種由来リボソームのペプチド合成活性」においては、原核細胞(大腸菌と好熱菌)、真核細胞(酵母)、および動物細胞ミトコンドリアから調製したリボソームによるオリゴペプチド合成に関して反応条件の最適化を行い、これらさまざまな生物のリボソームがいずれも高濃度ピリジン中でペプチド合成反応を行い得ることを示している。また、原核細胞と真核細胞の蛋白質合成反応をそれぞれ選択的に阻害する抗生物質(クロラムフェニコールとシクロヘキシミド)に対する感受性が、生体中におけるものと同様であることを示し、高濃度ピリジン中という環境においてもリボソームの活性部位の立体構造が保持されていること、従ってペプチド結合生成機構は細胞内におけるものと同様であることを結論している。さらに、これらの系の反応温度依存性を解析した結果、ミトコンドリア由来リボソームが60℃以上という高温において活性を上昇させることを見い出した。ミトコンドリアの系に関しては、金属イオンに対する依存性も他の系と大きく異なり、Mg2+の代わりにMn2+による活性上昇が認められた。また、リボソームから蛋白質を除去する際に用いる試薬LiClの存在下でもペプチド合成反応が十分に進行した。以上の新事実より、ミトコンドリアの系においてはペプチド合成反応にリボソーム蛋白質が関与している可能性は低く、活性の大半はrRNAによって担われている可能性が高いことを指摘している。 第4章は三級アミンを含む翻訳系の反応産物の解析結果を述べている。さまざまな濃度の鋳型存在下におけるpoly(U)依存ポリフェニルアラニン合成、およびpoly(A)依存ポリリジン合成において生成される産物量の経時変化を追跡し、HPLCによる産物の解析を行った結果、鋳型に依存したペプチド合成が生じていること、および重合度が数十の高分子が合成されていることがわかった。さらに、poly(UC)すなわちウリジン酸とシチジル酸との交互共重合体を鋳型とするポリ(セリン/ロイシン)の合成を試みた結果、生成ペプチドがセリンとロイシンとの交互共重合体であることを見い出した。この結果は、高濃度ピリジン存在下においても生体中と同様にして遺伝暗号の解読が行われていること(遺伝暗号UCUはセリンに、CUCはロイシンに対応している)を明確に示すものであり、高濃度ピリジンを含むペプチド合成系が、単なるペプチド結合生成系としてでなく、鋳型に依存した高分子合成系でもあることが結論された。 第5章ではさまざまな除蛋白処理を施したリボソームのペプチド合成活性について調べている。E.coliおよびT.thermophilusのリボームに対してSDSによるリボソーム蛋白質の変性、プロテアーゼによるリボソーム蛋白質の分解、さらにフェノール抽出による徹底した蛋白質除去といった処理を施した後、これらのリボソームによるポリフェニルアラニン合成を試みた。その結果、E.coliおよびT.thermophilusのリボームともSDS処理およびプロテアーゼ処理後も鋳型依存ペプチド合成活性を十分に残すこと、さらにT.thermophilusのリボームの場合はフェノール抽出後もペプチド合成活性をわずかに維持することがわかった。したがって、リボソームにおけるペプチド結合生成に関しては、リボソーム蛋白質ではなくrRNAが中心的役割を演じていることが示された。 第6章「金属イオンによるペプチド合成反応の制御」においては、Mn2+濃度を最適化することによって、E.coliリボソームによるpoly(U)依存ポリフェニルアラニン合成反応の鋳型依存度を飛躍的に増大させることができることを示した。そして、高濃度ピリジンを含むペプチド合成系の、鋳型高分子依存のポリペプチド合成システムとしての応用に関して考察している。 第7章は総合考察であり、本論文を総括した後、高濃度ピリジンを含むペプチド合成系の研究における今後の課題を明らかにするとともに、この系の今後の発展に関して考察している。生命現象の解明および新規な高分子合成システム開発にあたっては、最小構成要素からなるペプチド合成系を構築することが重要なステップであり、高濃度ピリジンを含むペプチド合成系がその第一歩となる可能性があることを示し、そのために必要な課題を述べている。 以上要するに、本論文はバクテリア・リボソーム系で新たに開発された、蛋白性因子とエネルギー非依存性のピリジン駆動型ペプチド合成システムが、真核細胞や細胞内小器官(オルガネラ)のリボソームでも成立することを初めて示し、全生物のリボソームに共通の反応系であることを実験的に証明し、かつ各々の系の特徴を詳細に検討し人工ペプチド合成システム構築のための有益な情報を収集したものである。このシステムは新規ペプチド合成システムとして工学的展開を計れる可能性が高いので、本論文はその基礎研究として工学に資するところが大きい。よって本論文は博士(工学)の学位請求論文として合格と認められる。 |