酵素標識抗体を用いた免疫測定法は、抗体-抗原反応を利用して微量な生体成分の濃度を感度良く分析測定する方法であり、臨床検査、免疫診断、微生物検査、ライフサイエンス研究などの分野において広く利用されている。発光酵素を抗体の標識に用いる生物発光法は、従来の発色反応を触媒する酵素や蛍光色素を標識に用いる吸光度法、蛍光法などの測定法と比較して原理的に高感度であり、光源を必要としないため光学測定系が単純化できるという特徴を有する。また、発光効率が化学発光法と比較して高く、バックグラウンド発光も低いため、化学発光法を凌ぐ高感度測定が期待できる。このような発光酵素としては、これまではホタルの発光酵素ルシフェラーゼの利用が試みられてきた。しかし、ホタル・ルシフェラーゼは安定性が低く、また、二官能性試薬を用いた酵素と抗体との化学的連結反応の位置特異性が低いため、目的とする酵素標識抗体の収率が低かったり、また抗原結合能や酵素活性が連結反応によって低下するなどの問題があった。このような点が、発光酵素を用いた生物発光免疫測定システムの実用化を阻む原因となっていた。 本論文は、安定性が極めて高く、近年その遺伝子がクローニングされたウミホタル(Vargula hilgendorfii)由来のルシフェラーゼと抗体に対する結合能を持つ蛋白質とのキメラ蛋白質を構築し、これを生物発光免疫測定システムに応用することを目的として行われた研究の成果を述べており、以下の8章から構成されている。 第1章は序論であり、本研究の背景と目的を述べている。 第2章では、関連する既往の研究を解説するとともに、本研究で用いたウミホタル・ルシフェラーゼならびに抗体結合能を有するプロテインAおよびプロテインGの特徴について述べている。 第3章では、本研究に用いた実験材料および遺伝子構築方法や動物細胞によるキメラ蛋白質の発現方法、キメラ蛋白質の特性の評価方法などの実験方法についてまとめている。 第4章では、プロテインAのDドメインとウミホタル・ルシフェラーゼのキメラ蛋白質を遺伝子工学的に作製し、その発光活性と抗体結合能の評価ならびに本キメラ蛋白質を応用した生物発光免疫測定結果について述べている。すなわち、プロテインAのDドメインのC末端側にウミホタル・ルシフェラーゼを連結したキメラ蛋白質においても、ウミホタル・ルシフェラーゼの発光活性ならびにその特徴である温度およびpHに対する高い安定性が保持されることを明らかにしている。また、Dドメインとウミホタル・ルシフェラーゼを直接連結すると抗体に対する結合能は失われてしまうが、これらの問に5アミノ酸(Gly4Ser)からなる柔軟なリンカーペプチドを導入することによって抗体結合能が回復することを見出している。このように、抗体結合能がリンカーペプチドの有無によって変化する原因として、プロテインAのDドメインC末端側に存在する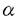 ヘリックスの2次構造がルシフェラーゼに直接連結された場合には不安定となり、その結果、抗体との相互作用が低下した可能性を指摘している。さらに、本キメラ蛋白質を生物発光免疫測定システムに応用し、サンドイッチELISA法により10-11から10-9Mの抗原(モノクロナール・マウス抗Tri-nitrophenyl抗体)濃度を感度良く検出できることを明らかにしている。このように、抗体と本キメラ蛋白質を混合するだけでアフィニティ結合により抗体を高収率に標識化することが可能となり、また、化学的連結反応を用いた酵素標識法で問題となった、抗体との結合に伴うルシフェラーゼ発光活性の低下や標識された抗体の抗原結合能の低下もほとんど見られず、また広い濃度範囲の抗原濃度を感度良く検出できたことより、本キメラ蛋白質が免疫測定用試薬として極めて高い有用性を持つと結論づけている。 ヘリックスの2次構造がルシフェラーゼに直接連結された場合には不安定となり、その結果、抗体との相互作用が低下した可能性を指摘している。さらに、本キメラ蛋白質を生物発光免疫測定システムに応用し、サンドイッチELISA法により10-11から10-9Mの抗原(モノクロナール・マウス抗Tri-nitrophenyl抗体)濃度を感度良く検出できることを明らかにしている。このように、抗体と本キメラ蛋白質を混合するだけでアフィニティ結合により抗体を高収率に標識化することが可能となり、また、化学的連結反応を用いた酵素標識法で問題となった、抗体との結合に伴うルシフェラーゼ発光活性の低下や標識された抗体の抗原結合能の低下もほとんど見られず、また広い濃度範囲の抗原濃度を感度良く検出できたことより、本キメラ蛋白質が免疫測定用試薬として極めて高い有用性を持つと結論づけている。 第5章では、プロテインGのB1ドメインとウミホタル・ルシフェラーゼのキメラ蛋白質(SpG-Lu)およびプロテインGのB1ドメイン、プロテインAのDドメイン、ウミホタル・ルシフェラーゼの順にリンカーペプチドを介して結合したキメラ蛋白質(SpG-SpA-Lu)を遺伝子工学的に作製し、その発光活性と抗体結合能の評価結果について述べている。すなわち、SpG-Luの場合には、発光活性は保持されていたものの、リンカーペプチドの有無に関わらずB1ドメインの抗体結合能は失われていたが、DドメインをB1ドメインとルシフェラーゼの間に導入したSpG-SpA-LuではB1ドメインの抗体結合能が回復することを明らかにしている。また、ここで作製した2種の抗体結合ドメインを持つSpG-SpA-Luは、抗体に対する結合量がSpA-Luの約2〜3倍と高く、さらに、抗体のサブクラスに対する結合特異性のスペクトルがプロテインAおよびプロテインGそれぞれのスペクトルを足し合わせたものになるため、SpA-Luよりさらに高感度で、かつ多種のサブクラスの抗体に対して応用可能な免疫測定用試薬になったと結論づけている。 第6章では、発光蛋白質アクオリンに存在し、かつ、ウミホタル・ルシフェラーゼのアミノ酸配列中のN末端側とC末端側に一箇所づつ存在する弱いホモロジー領域が発光活性を担う部位である可能性を検証するために、ウミホタル・ルシフェラーゼのC末端側に存在するホモロジー領域を含む約240個のアミノ酸を除いたSpG-Luを作製し、その発光活性および安定性について検討している。その結果、本キメラ蛋白質にはSpA-Luの約40%の発光活性が残存しており、弱いホモロジー領域が発光活性を担っている可能性が高いと推察している。しかし、C末端側約240個のアミノ酸の削除により発光活性の安定性は顕著に低下したため、ウミホタル・ルシフェラーゼの安定性の維持にはほぼ全体の領域が必要であると結論づけている。 第7章では、本論文を総括し、今後の展望を述べている。第8章は、結言である。 以上、本論文は安定性が極めて高いウミホタル・ルシフェラーゼと抗体結合能を持つプロテインAおよびプロテインGとのキメラ蛋白質を作製し、その発光活性ならびに抗体結合能を評価すると共に、本キメラ蛋白質が免疫測定用試薬として生物発光免疫測定システムへ応用可能なことを示したものであり、化学生命工学とくに免疫測定、免疫診断分野の進展に寄与するところが大きい。 よって本論文ナは博士(工学)の学位請求論文として合格と認められる。 |