学位論文要旨
| No | 111941 | |
| 著者(漢字) | 菊池,潔 | |
| 著者(英字) | Kikuchi,Kiyoshi | |
| 著者(カナ) | キクチ,キヨシ | |
| 標題(和) | キンギョの温度馴化に関する分子生物学的研究 | |
| 標題(洋) | Molecular Biological Studies on Temperature Acclimation in the Goldfish | |
| 報告番号 | 111941 | |
| 報告番号 | 甲11941 | |
| 学位授与日 | 1996.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(農学) | |
| 学位記番号 | 博農第1657号 | |
| 研究科 | 農学生命科学研究科 | |
| 専攻 | 水圏生物科学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 生体内の化学的反応の多くは温度依存性を示すことから,環境水温の変動は変温動物である魚類に極めて大きな影響をもたらす。したがって,温度適応という現象の解明は魚類の生理生態を理解する上で不可欠と考えられる。現在までに,多くの魚種が温度適応によって酵素活性を含めた生体の代謝活性を変化させることが知られているが,その調節機構はほとんど不明とされている。この温度適応は,短時間の温度変化に対する適応,適応に数日を要する温度馴化,遺伝形質として受け継がれる適応の3つの様式に分けられる。本研究では,広温域性魚類であるキンギョを材料とし,温度馴化の調節機構を分子生物学的手法を用いて明らかにすることを試みた。まず,温度馴化に伴うタンパク質組成の変化を分析した。次いで,高温馴化に伴って発現量が増大することが明らかとなった65kDa成分を単離した。さらに,この成分のcDNAクローニングを行い,一次構造を演繹するとともに,温度馴化に伴う65kDa成分遺伝子の転写産物量の変化や,その調節機構を調べた。 馴化に伴うタンパク質組成の変化を明らかにするため,10または30℃で5週間以上飼育し充分馴化させたキンギョ(35-45g)を即殺し,筋肉,脳および肝膵臓から抽出液を調製した。まず,筋肉抽出液を,等電点電気泳動を1次元目,SDS-PAGEを2次元目とする2次元電気泳動に付した。その結果,30℃馴化魚では,著しく酸性側に等電点をもつ分子量65kDaの成分がきわだって多いことが判明した。逆に10℃馴化魚では,65kDa成分とほぼ同じ等電点を有する55kDa成分の割合が高かった。30℃馴化に伴う65kDa成分の増大は,血清,脳,肝膵臓の抽出液でも観察された。このほか,SDS-PAGE分析によって,30℃馴化魚は脳抽出液で27kDaおよび200kDa以上の2成分を,さらに肝臓では27kDaおよび97kDaの2成分を,いずれも10℃馴化魚に比べて特異的に多く含むことが認められた。 キンギョの高温馴化に伴って筋肉中に発現する65kDa成分を2次元電気泳動ゲルから単離し,これを抗原として特異抗体を作製した。この抗体を用いたWestern blot法により,各組織における65kDa成分の同一性が示された。一方,この65kDa成分は,分子量,等電点,および各組織に普遍的に存在することなどに,既報の70kDa熱ショックタンパク質(HSP70)との類似性がみられた。そこで,HSP70の特性であるATP結合性を調べるために,高温馴化キンギョの筋肉抽出液をATP-アガロースカラムに供したが,65kDa成分はカラムに吸着されなかった。したがって,本65kDa成分はHSP70とは異なるタンパク質と判断された。また,20時間で20℃から30℃へ水温を上昇させた後30℃に水温を保持して,高温馴化に伴う筋肉中の65kDa成分の経時的変化をWestern blot法を用いて調べた。その結果,本成分は,温度上昇後3日以降6日以内に発現量が増大し,少なくとも実験終了時の9日目までその濃度が維持された。以上の結果より,高水温に対する持続的な反応である高温馴化という現象に,65kDa成分が密接に関与していることが示された。そこで,本成分をWap65(warm temperature acclimation-related 65kDa protein)と名づけた。 SDS-PAGEからの調製量では,一次構造の広範囲な同定などといった生化学的分析には困難が伴う。そこで,分子量および特異抗体による反応を指標とし,イオン交換カラム,ゲル濾過カラム,逆相カラムを用いたクロマトグラフィーで,キンギョ背側筋より,Wap65をより多く精製することを試みた。精製したWap65はSDS-PAGE上,単一バンドを示した。ゲル濾過法により分子量は65,000と同定され,本タンパク質はサブユニット構造をとらないことが示された。また,精製標品をN末端アミノ酸配列分析に付したところ,44残基が同定された。タンパク質の一次構造のデータベースを検索した結果,Wap65のアミノ酸配列は,ホウレンソウRNAポリメラーゼ Wap65の機能をより詳しく推定するために,全一次構造の演繹をcDNAの塩基配列を決定することで試みた。まず,先に得られたアミノ酸配列をもとにプライマーを作製し, Wap65遺伝子発現の組織特異性を,キンギョ高温馴化魚の肝膵臓,腸,卵巣,心臓,鰓,眼球,皮膚,血球,筋肉,脳につき,RT-PCR法で調べたところ,肝膵臓で多量に発現していることが再確認された。他の組織では,心臓および筋肉にのみ,わずかな発現が認められた。先にWap65は筋肉,脳,血清などに検出されたことを述べたが,これは肝膵臓で合成されたWap65が循環系に分泌された後,各組織に運ばれたことを示すものと判断された。次に,10℃および30℃馴化魚で肝膵臓におけるWap65の転写産物量を比較したところ,30℃馴化魚で有意に多く,温度による発現調節が転写レベルでなされていることが示された。また,Western blot解析の場合と同様の条件で10℃から30℃へ高温馴化させて,肝膵臓中のWap65転写産物量の経時的変化を調べたところ,その量は温度上昇後3日で10℃馴化魚の40倍に達した。その後は減少傾向を示し,21日後には10℃馴化魚の10倍となり,フィードバック機構を含む複雑な調節機構が存在する可能性が示唆された。これらの発現調節の分子的機構を明らかにするため,推測プロモータ領域の解析を行った。まず, 本研究によって,キンギョには高温馴化に伴って発現量が増大するタンパク質が存在すること,さらに,このタンパク質の発現量が転写レベルで調節されていることなど,魚類の温度馴化機構の一端が明らかとなった。本研究で得られた結果は,魚類の温度適応機構を解明する上で重要な基礎的知見をなすと考えられる。 | |
| 審査要旨 | 環境水温の変動は変温動物である魚類に極めて大きな影響をもたらす。したがって、温度適応機構の解明は魚類の生理生態を理解する上で不可欠と考えられる。本論文は、広温域性魚類であるキンギョをモデルとして、温度馴化の調節機構の一端を分子生物学的手法を用いて明らかにすることを目的としている。論文内容の概要は以下の通りである。 10または30℃で5週間以上飼育し充分馴化させたキンギョの筋肉抽出液を、2次元電気泳動に付した。その結果、30℃馴化魚では、10℃馴化魚に比べて分子量65kDaの成分が増加することが判明した。10℃馴化魚では、55kDa成分の割合が増加した。30℃馴化に伴う65kDa成分の増大は、血漿や脳・肝膵臓抽出液でも観察された。この他、30℃馴化魚の脳抽出液には27kDaおよび200kDa以上の2成分が、さらに肝膵臓抽出液には27kDaおよび97kDaの2成分が、10℃馴化魚に比して多く含まれていた。 高温馴化に伴って筋肉中に発現する65kDa成分の特異抗体を作製し、Western blot法により、各組織における65kDa成分の同一性を示した。また、この65kDa成分は、70kDa熱ショックタンパク質の特性であるATP結合能を持たないことが、ATP-アフィニティクロマトグラフィーによって示された。20℃から30℃へ水温を上昇させた後30℃に水温を保持して、高温馴化に伴う筋肉中の65kDa成分の経時的変化を調べたところ、本成分は、温度上昇後3日以降6日以内に発現量が増大し、少なくとも実験終了時の9日目までその濃度が維持された。以上の結果より、高温馴化という現象に65kDa成分が密接に関与していることが示された。そこで、本成分をWap65(warm temperature acclimation-related 65kDa protein)と名づけた。 イオン交換カラム、ゲル濾過カラム、逆相カラムを用いたクロマトグラフィーで、キンギョ背側筋よりWap65を精製した。ゲル濾過法により分子量は65kDaと同定された。また本タンパク質はサブユニット構造をとらないことも示された。さらに、精製標品をN末端アミノ酸配列分析に付したところ44残基が同定された。 Wap65の転写産物が多量に存在する肝膵臓からcDNAライブラリーを構築し、Wap65の分子全体(445アミノ酸残基)をコードするcDNA(1761bp)をクローン化した。データベースの検索の結果、この成分はラットのヘモペキシンと31%の相同性を示した。しかし、Wap65はヘモペキシンのヘム結合性に関与するヒスチジンを欠いていた。そこで、ヘム結合性を調べるため、ヘムーアフィニティクロマトグラフィーを行ったが、Wap65はヘムアガロースに対する吸着性を示さなかった。以上のことから、Wap65はヘモペキシンとは異なった生理的機能を持つことが示唆された。 RT-PCR法により、Wap65遺伝子は肝膵臓特異的に発現することが示された。また、Northern blot法により、30℃馴化魚の肝膵臓におけるWap65転写産物量は10℃馴化魚の約10倍であることが明らかとなった。次に、Wap65遺伝子の5’領域をコードする遺伝子をクローン化し、転写調節に関与している配列を推定した。その結果、恒常的発現に関与する配列に加え、肝臓での特異的な発現に関与する配列や、免疫系の関与を示唆する配列も見出された。そこで、エンドトキシンを10℃馴化魚の腹腔内に注入したところ、Wap65の転写産物量は有意に上昇し、Wap65は高温馴化のみならず生体防禦にも関連することが示された。 以上、本論文は、キンギョで高温馴化に伴って発現量が増大するタンパク質を発見しその構造を明らかにするとともに、このタンパク質の発現量が転写レベルで調節されていること、さらに発現には水温上昇ばかりでなく免疫系も関与していることを示したもので、学術上、応用上寄与するところが大きい。よって、審査員一同は本論文が博士(農学)の学位論文として価値あるものと認めた。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54527 |
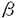 ’サブユニットおよびヒト由来チロシン水酸化酵素のアミノ酸配列の一部と,それぞれ29,および,26%の相同性を示した。しかしながら,HSP70のとの相同性は全く認められなかった。
’サブユニットおよびヒト由来チロシン水酸化酵素のアミノ酸配列の一部と,それぞれ29,および,26%の相同性を示した。しかしながら,HSP70のとの相同性は全く認められなかった。 ZAPIIを用いて構築したキンギョ背側筋cDNAライブラリーを鋳型として,PCRを行った。その結果,アミノ酸配列に対応した塩基配列を持つDNA断片が得られた。また,Wap65の転写産物が筋肉組織中で発現していることも示された。次に,Northern blot法を用いてWap65の転写産物量を,脳,筋肉,肝膵臓,血球につき調べたところ,高温馴化魚の肝膵臓で多量に発現していることが明らかとなった。効率の良いスクリーニングを行うため,Wap65の転写産物が多量に存在する肝膵臓からcDNAライブラリーを構築し,PCRで得られたDNA断片をプローブとしてプラークハイブリダイゼーションを行った。ポジティブクローンをDyeDeoxy Terminatorを用いるサイクルシークエンス法で解析し,Wap65の分子全体(445アミノ酸残基)をコードする領域を含むcDNA(1761bp)の全塩基配列を決定した。データベースの検索の結果,この成分はラット・ヘモペキシンと31%の相同性を示した。また,Wap65とへモペキシンの間でシステインの位置が高度に保存されていることから,両者は類似した高次構造を形成すると推測された。さらに,Wap65はペキシン・ファミリーに特異的なペプチドの繰り返し構造も保持していた。しかし,Wap65はへモペキシンのヘム結合性に関与するヒスチジンを欠いていた。そこで,ヘム結合性を調べるため,ヘム・アフィニティクロマトグラフィーを行ったが,キンギョWap65はヘム・アガロースに対する吸着性を示さなかった。以上のことから,Wap65はヘモペキシンとは異なった生理的機能を持つことが示唆された。
ZAPIIを用いて構築したキンギョ背側筋cDNAライブラリーを鋳型として,PCRを行った。その結果,アミノ酸配列に対応した塩基配列を持つDNA断片が得られた。また,Wap65の転写産物が筋肉組織中で発現していることも示された。次に,Northern blot法を用いてWap65の転写産物量を,脳,筋肉,肝膵臓,血球につき調べたところ,高温馴化魚の肝膵臓で多量に発現していることが明らかとなった。効率の良いスクリーニングを行うため,Wap65の転写産物が多量に存在する肝膵臓からcDNAライブラリーを構築し,PCRで得られたDNA断片をプローブとしてプラークハイブリダイゼーションを行った。ポジティブクローンをDyeDeoxy Terminatorを用いるサイクルシークエンス法で解析し,Wap65の分子全体(445アミノ酸残基)をコードする領域を含むcDNA(1761bp)の全塩基配列を決定した。データベースの検索の結果,この成分はラット・ヘモペキシンと31%の相同性を示した。また,Wap65とへモペキシンの間でシステインの位置が高度に保存されていることから,両者は類似した高次構造を形成すると推測された。さらに,Wap65はペキシン・ファミリーに特異的なペプチドの繰り返し構造も保持していた。しかし,Wap65はへモペキシンのヘム結合性に関与するヒスチジンを欠いていた。そこで,ヘム結合性を調べるため,ヘム・アフィニティクロマトグラフィーを行ったが,キンギョWap65はヘム・アガロースに対する吸着性を示さなかった。以上のことから,Wap65はヘモペキシンとは異なった生理的機能を持つことが示唆された。