| 内容要旨 | | 第一章緒言 タンパク質工学において.意図した構造,機能,物性をもった分子を計算機により設計する方法を確立することは重要な課題の一つである.タンパク質内部の疎水性コアは,複雑で密にパッキングしており,構造の安定性に大きく寄与していると考えられている.そこで,疎水性コアを構成しているアミノ酸を改変することにより,構造安定性の理解および安定性の向上が期待される.タンパク質内部の側鎖は相補的に密なパッキングをしているため,特定の一つのアミノ酸の置換でも,そのアミノ酸が他のアミノ酸に置換されたという直接的な変化のほかに,その近傍の構造変化を引き起こす.従って,コア領域の改変を設計するには,一つのアミノ酸の側鎖構造の変更が引き起こすすべての変化を考慮する必要がある.さらに.同時に複数のアミノ酸置換を考慮したコア領域の改変の影響を見積もるには,一層精密なモデリングが必要である. 本研究では,タンパク質の側鎖構造に注目し,側鎖のモデリング,疎水性コア領域に対する配列の予測および改変タンパク質の熱力学的安定性の予測を行なった.さらに,これらの結果に基づき,高度好熱性細菌Thermus flavusのリンゴ酸デヒドロゲナーゼ(以下tMDH),大腸菌由来のリンゴ酸デヒドロゲナーゼ(以下eMDH)の疎水性コアを新たに設計し,実験的に改変体を作成した.円偏光二色性スペクトル(以下,CD)の測定から,それらの熱力学的安定性を調べ,計算結果と比較検討することにより,設計手法の改善を計った. 第二章側鎖の構造 タンパク質立体構造データベース(PDB)に登録されているタンパク質の種類には偏りがある.そこで,その偏りをなくすため,データベースに登録されているタンパク質をアミノ酸配列データベース(PIR)のスーパー・ファミリーの指標に従って分類した.その中から最も解像度のよい構造を一つずつ選択して,総数100のタンパク質の側鎖配座をクラスター分解し,rotamer libraryとしてまとめた.この統計解析の結果,疎水性残基に対しては,数種類程度の配座でデータベースの全配座をほぼ表現できるのに対し,親水性残基の配座は多いもので100以上の配座を要した.しかし,大部分のアミノ酸の配座は10種類程度のrotamerで表現できることがわかった.また,側鎖配座の主鎖依存性を調べるため,主鎖の二次構造に対応する二面角によって側鎖を分類し配座解析を行なった.その結果,各分類の側鎖配座の種類は似ており,顕著な主鎖依存性は見つからなかった.しかし,対応する配座間には,二面角で10°程度の差が観察され,これが次章で述べる側鎖のモデリング精度に影響を与えた. 第三章側鎖構造のモデリング 二章で述べたrotamer librayを用いて側鎖のモデリングを行なった.rotamer libraryを用いて側鎖配座の数を絞り込んでも,すべての側鎖の組合せを全回探索することは不可能である.そこで,側鎖が密にパッキングすることを条件にして,側鎖配座の最適解,もしくはそれに準ずる解を有限時間内に求める方法を開発した[1].本手法では,側鎖の配座空間を限定するために,前章で述べたrotamerを用いる.rotamer一つずつには,automatonが割り当てられ,それらを相互に結合してHopfield型networkを構成する.automatonは側鎖間の相互作用に基づいた状態遷移規則に従ってタンパク質の構造エネルギーに対応するnetworkのエネルギーを最小化し配座を決定する. モデリング精度は,結晶構造と対比した最小自乗誤差(以下,r.m.s.d),結晶構造の二面角との差異が±40°以内の側鎖の割合(以下,正答率)および水素結合の再現率で評価した.21の球状タンパク質について計算した結果,溶媒から露出していない残基(埋もれた残基)の平均r.m.s.d.は,1.10Aで,埋もれた残基の 1の正答率は87.3%であった.これらの値は従来の方法よりもよい値であった.また,水素結合の再現率は水素結合エネルギーを考慮することにより,考慮しない場合の33%から52%に改善できた.さらに,ホモロジーモデリングにおけるモデリング精度を検討するため,ヒトのリゾチームの主鎖構造からhenのリゾチームの側鎖を,henのリゾチームの主鎖構造からヒトのリゾチームの側鎖をモデリングし正しい主鎖構造から側鎖のモデリング(つまり,ヒトのリゾチームからヒトのリゾチームの側鎖のモデリング,またはhenからhen)とほぼ同等のモデリング精度を実現できた(図1). 1の正答率は87.3%であった.これらの値は従来の方法よりもよい値であった.また,水素結合の再現率は水素結合エネルギーを考慮することにより,考慮しない場合の33%から52%に改善できた.さらに,ホモロジーモデリングにおけるモデリング精度を検討するため,ヒトのリゾチームの主鎖構造からhenのリゾチームの側鎖を,henのリゾチームの主鎖構造からヒトのリゾチームの側鎖をモデリングし正しい主鎖構造から側鎖のモデリング(つまり,ヒトのリゾチームからヒトのリゾチームの側鎖のモデリング,またはhenからhen)とほぼ同等のモデリング精度を実現できた(図1). 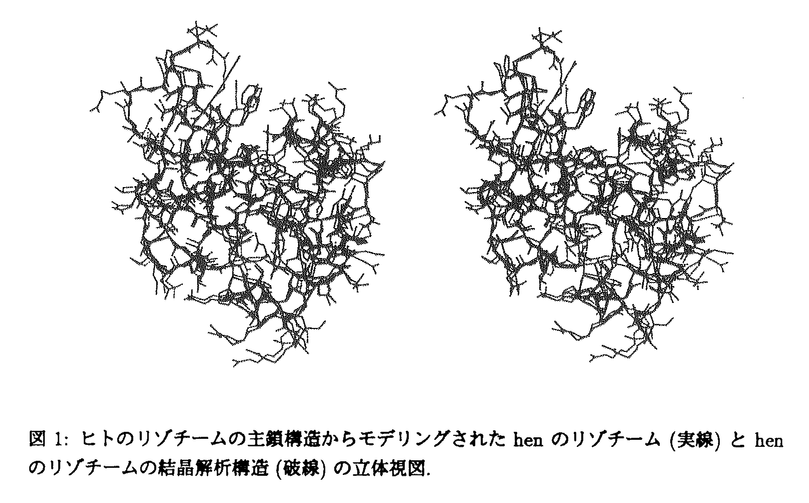 図1:ヒトのリゾチームの主鎖構造からモデリングされたhenのリゾチーム(実線)とhenのリゾチームの結晶解析構造(破線)の立体視図. 図1:ヒトのリゾチームの主鎖構造からモデリングされたhenのリゾチーム(実線)とhenのリゾチームの結晶解析構造(破線)の立体視図. また,主鎖構造のrotamer libraryを使うことで,従来の主鎖構造に依存しないrotamerを用いた場合よりも,r.m.s.d.値は埋もれた残基に対して0.23A,全体で0.26A改善された[2].これらの改善は,主鎖依存のlibraryが二次構造の違いによる側鎖の配座の微妙な差を反映し,従来のrotamerで生じた原子同士の衝突を回避できたからだと考えられる. 第四章主鎖構造に最適な配列の予測 主鎖構造に対する最適な配列を予測する問題は,改変体,人工タンパク質の設計において重要である.そこで,配座空間と同時に配列空間を考えてタンパク質の疎水コア領域に適合するアミノ酸配列を自動的に予測する手法を開発した[3].第三章で述べたように,側鎖の構造を離散的なrotamerで表現することで,効果的に探索配座空間を狭め,アミノ酸側鎖の密なパッキングを条件に最適な配列を探索した. 本手法により, helix bundle構造のcytochrome b562, helix bundle構造のcytochrome b562, / / 型構造のtriosephosphate isomerase, 型構造のtriosephosphate isomerase, 型構造の疎水コア部分の16,18,13残基のアミノ酸の配列及び配座を予測した.その結果,得られた配列は3つのタンパク質ともに天然配列を含み,その配列の種類は170,70,26であった.解の中には,エネルギー的に天然のものよりも低い配列も得られた.それらの配列の側鎖の配座は,天然の配座と一致していた.得られた配列及びその立体構造は,すべて側鎖が相補的にパッキングし,天然のタンパク質と同様に密に充填された構造をとっていた.また,側鎖の体積は天然のものと比べてメチル基に換算して±3程度であった.このように,天然タンパク質と同様,もしくはそれ以上に密にパッキングする配列を得ることができた.得られた配列の種類は,総組合せの1019分の1以下であり,密なパッキングを条件にすることにより,配列空間が大きく限定されることを示している.このことは.密なパッキングが天然タンパク質の立体構造を形成するため主要な要因の一つであるという説と合致している. 型構造の疎水コア部分の16,18,13残基のアミノ酸の配列及び配座を予測した.その結果,得られた配列は3つのタンパク質ともに天然配列を含み,その配列の種類は170,70,26であった.解の中には,エネルギー的に天然のものよりも低い配列も得られた.それらの配列の側鎖の配座は,天然の配座と一致していた.得られた配列及びその立体構造は,すべて側鎖が相補的にパッキングし,天然のタンパク質と同様に密に充填された構造をとっていた.また,側鎖の体積は天然のものと比べてメチル基に換算して±3程度であった.このように,天然タンパク質と同様,もしくはそれ以上に密にパッキングする配列を得ることができた.得られた配列の種類は,総組合せの1019分の1以下であり,密なパッキングを条件にすることにより,配列空間が大きく限定されることを示している.このことは.密なパッキングが天然タンパク質の立体構造を形成するため主要な要因の一つであるという説と合致している. 第五章改変タンパク質の熱力学的安定性の予測 タンパク質の熱力学的安定性は,ネイティブ状態と変性状態のギブス自由エネルギーの差で表される.今回注目した疎水性コア部分の熱力学的安定性への寄与は大別して疎水性(溶媒の極性原子からの隔離)とパッキング効果の2つに分けて考えることができる.前者は,極性溶媒から無極性溶媒への移相自由エネルギーで定量化される.後者は,さらに以下の3つの要素1)非結合エネルギー2)結合エネルギー3)主鎖,側鎖のエントロピーに分けて考えることができる.従って,配列iの安定性は,ネイティブ状態(N)と変性状態(U)でのエネルギー(E)の差,  で表される.また,二つの配列i,jのエネルギーの差は図2に示す熱力学的サイクルに従って,  と表される.従って,式(1),(2)に基づいて各要素ごとの差をとることで,二つの配列i,jのエネルギー差は次式で表される.  本方法では,この式に基づいて天然型と改変体との熱力学的安定性の差を見積もった. 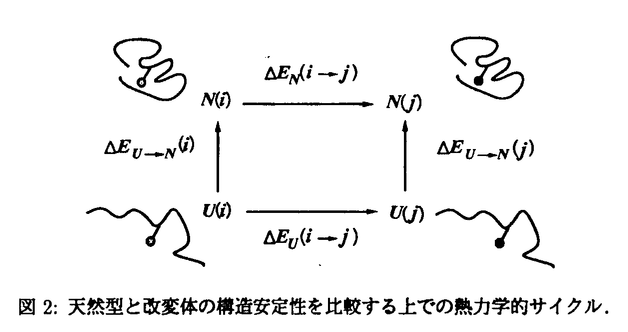 図2:天然型と改変体の構造安定性を比較する上での熱力学的サイクル. 図2:天然型と改変体の構造安定性を比較する上での熱力学的サイクル. 式(3)の第一項は,水和エネルギーに相当し,側鎖を水から気相へ移行する際の自由エネルギー変化の値と溶媒露出表面積に基づいて計算した. 式(3)の第二項は,エントロピーを表す.エントロピー(S)は,ネイティブ状態と変性状態で主鎖のエントロピーは天然型と改変体で等しいと仮定し,側鎖のエントロピーのみを考慮した.側鎖のエントロピーは低分子の融解エントロピーから推定された値を用いた.ネイティブ状態のエントロピーは0と仮定し,変性状態のエントロピーの差のみを考慮した.また,主鎖構造は固定して扱った. 式(3)の第三項は,非結合エネルギーを表す.変性状態では溶媒との相互作用を考えると天然型と改変体で等しいと考えられる.従って,ネイティブ状態のエネルギー差のみを考慮した.パラメータは,AMBER 3Aのforce fieldを使用した.本研究では,内部に埋もれた非極性残基の改変に注目しているので,van der Waals相互作用のみを考慮した. 式(3)の第四項の結合エネルギーはN状態とU状態で等しいと仮定し, (i→j)=0とした. (i→j)=0とした. 以上の方法によりbarnaseの天然型と改変体の自由エネルギー差を計算した結果,実験値と高い相関値を得た(0.95)[4].しかし,計算された値は,実験値の約2倍であった.この不一致は,実際のタンパク質では改変によるエネルギー的なロスを最小限にとどめるように,主鎖構造をシフトしていることに起因すると考えられる.この主鎖構造のシフトを取り込むことが今後の課題である. 第六章改変タンパク質の作成とその熱力学的安定性の解析 第五章で述べた計算方法より,tMDHとeMDHの疎水性コア領域の設計を行なった.tMDHの改変体はKunkel法で4種類,eMDHの改変体はPCR法で6種類作成した.円偏光二色性スペクトルの測定の結果,改変体は設計通り天然型と同量の二次構造を含有していることが確認された.さらに,熱力学的安定性を調べるため,tMDHの場合はCD値の変性剤依存性を,eMDHの場合はCD値の温度依存性を測定した.tMDHの変性剤による変性過程は,得られた転移曲線のタンパク質濃度依存性から,D(ネイティブ二量体) M(ネイティブ単量体) M(ネイティブ単量体) 2U(変性単量体)の三状態変性であると考えられた.この仮定に基づいて実験から求めた自由エネルギー変化と計算値は一つの改変体を除いて高い相関があった.しかし,計算値は実験値よりも前述の場合と同様に約2倍大きかった.これは,定性的には計算の妥当性を示すが,実際の改変体では計算では考慮していない変化,おそらく,主鎖構造のシフトに起因しているものと考えられる. 2U(変性単量体)の三状態変性であると考えられた.この仮定に基づいて実験から求めた自由エネルギー変化と計算値は一つの改変体を除いて高い相関があった.しかし,計算値は実験値よりも前述の場合と同様に約2倍大きかった.これは,定性的には計算の妥当性を示すが,実際の改変体では計算では考慮していない変化,おそらく,主鎖構造のシフトに起因しているものと考えられる. 第七章結論 以上,本研究では,側鎖配座を離散的なrotamerで表現することにより配座空間を制限することができた.rotamer表現に基づくHopfield型networkを用いて,タンパク質の構造エネルギーを最小化することにより,側鎖をモデリングする方法を開発し,精度のよいモデリングを実現した.また,アミノ酸改変による熱力学的安定性の変化を考慮し,疎水性コア領域に対するアミノ酸配列設計方法を考案した.さらに,その方法に基づき改変タンパク質を作成した.改変タンパク質の熱力学的安定性を測定した結果,天然型とほぼ同等な安定性を持った改変体が作成できた.これは,新しい疎水性コアの設計を意味し,人工タンパク質の設計に有効な手法として役立つと考えられる. 参考文献[1]Kono,H.and Doi,J.A new method for side-chain conformation prediction using a Hopfield network and reproduced rotamers.J.Compt.Chem.,submitted.[2]Kono,H.and Doi,J.Backbone-dependent rotamers for side-chain conformation prediction.Protein Science,Vol.4 Suppl.2,p.85,1995.[3]Kono,H.and Doi,J.Energy minimization method using automata network for sequence and side-chain conformation prediction from given backbone geometry.Proteins:Struct.Funct.Genet.,Vol.19,pp.244-255,1994.[4]Kono,H.and Doi,J.Sequence Generation Method for De Novo Design of Proteins using Automata Network Based on Side-chain Packing.Mayflower Worldwide,1995. |