活性中心に2個のアスパラギン酸残基を有するアスパラギン酸プロテアーゼ群は、牛のキモシン、ケカビ由来のムコールペプシン等の凝乳酵素に加えて、胃での消化に関わるペプシン、血圧の調節に関わるレニンといった生理的に重要なプロテアーゼ、さらにはエイズ発症の原因ウィルスであるHIVウィルスの成熟化に関与するHIVプロテアーゼ等を含んでいる。幾つかのアスパラギン酸プロテアーゼの立体構造決定の結果から、アミノ酸配列自体の相同性は余り高くないこれらのアスパラギン酸プロテアーゼが、 -シートに富んだクロワッサン様の共通した構造をとっていることが明らかになった。アスパラギン酸プロテアーゼの酵素蛋白は構造上非常に類似したN末およびC末ドメインから成る二葉構造をとっている。その二つのドメインの間にクレフトと呼ばれる大きな溝があって、その最深部に活性中心を構成する2個のアスパラギン酸残基が存在していること、さらには基質類似の阻害剤を用いた解析から基質クレフトにはS5-S3’からなるサブサイトが存在することなどの基本構造が明らかとなっている。しかしながら、アスパラギン酸プロテアーゼの反応機構に関しては、種々の合成ペプチドを用いた反応速度論的解析が精力的に行われているものの、2つのアスパラギン酸残基が活性中心として機能すること以外に、未だ推測の域を出ていないのが実状である。 -シートに富んだクロワッサン様の共通した構造をとっていることが明らかになった。アスパラギン酸プロテアーゼの酵素蛋白は構造上非常に類似したN末およびC末ドメインから成る二葉構造をとっている。その二つのドメインの間にクレフトと呼ばれる大きな溝があって、その最深部に活性中心を構成する2個のアスパラギン酸残基が存在していること、さらには基質類似の阻害剤を用いた解析から基質クレフトにはS5-S3’からなるサブサイトが存在することなどの基本構造が明らかとなっている。しかしながら、アスパラギン酸プロテアーゼの反応機構に関しては、種々の合成ペプチドを用いた反応速度論的解析が精力的に行われているものの、2つのアスパラギン酸残基が活性中心として機能すること以外に、未だ推測の域を出ていないのが実状である。 我々の研究室では、チーズ製造に必須な凝乳酵素である、仔牛第四胃から得られるキモシン及び毛カビRhizomucor pusillusの生産するキモシンの代替酵素ムコールペプシン(MPP)の研究が行われてきた。キモシンに関してはその前駆体であるプロキモシンのcDNAをクローン化し、大腸菌において発現させた後、蛋白工学的研究を行い、従来S1サブサイトと考えられていたTyr75が基質認識の機構を担うだけでなく触媒活性にも関与すること等が明らかになった。また、MPPについては、Rpusillusよりクローン化したその遺伝子を、酵母GAL7プロモーターの制御下においたプラスミドをSaccharomyces cerevisiaeに導入することで、200mg/l以上の活性型MPPを培地中に分泌する系を開発した。MPPの酵母における分泌の際にAsn72とAsn171への糖鎖付加が起こり、最初プロ配列を持つ不活性型酵素として分泌され、自己触媒的にあるいは、宿主のプロテアーゼによってプロ配列が切断され活性型に変換されることが明らかになっている。 本研究は以上の成果をふまえて、MPPを用いて蛋白工学的研究を行い、アスパラギン酸プロテアーゼ全般に適用できる構造と機能の相関関係の直接的な情報を得ること、構造的安定性を担っているアミノ酸残基の同定を目的としている。また、部位特異的変異によって新たに導入された糖鎖付加部位への糖鎖付加や機能に及ぼす影響を明らかにすることを目的とする。以上のような基礎研究に加え、MPPの実用面についても評価することを目的とする。 I.サブサイトを構成しているアミノ酸残基の解析(1)サブサイトを構成しているアミノ酸残基の部位特異的変異 活性中心の2つのAsp残基が位置するクレフトと可動性のフラップ領域に基質と相互作用すると予想される十数個のアミノ酸残基がS5からS3’までのサブサイトを構成している。他のアスパラギン酸プロテアーゼのサブサイトを構成しているアミノ酸との比較から、それらのうち9ケ所、12種類の変異型MPPについて、2種類の合成基質、Leu-Ser-Phe(NO2)-Nle-Ala-Leu-OMe(1)及びLys-Pro-Ile-Phe-Phe(NO2)-Arg-Leu-OH(2)を用いて、反応速度論的解析を行なった。その結果、特にS1サブサイトのIle120Asn、S3及びS4のAsn219Ser、S3のGlu13GlnとIle222Thrで大きな変化が見られ、 -カゼインをモデルした基質1ではkcatが減少、アスパラギン酸プロテアーゼの一般的な基質2ではKmが上昇した(図1)。このことは、活性中心から離れたサブサイトが基質認識だけでなく酵素の反応機構にも協奏的な作用を及ぼしていることを示している。 -カゼインをモデルした基質1ではkcatが減少、アスパラギン酸プロテアーゼの一般的な基質2ではKmが上昇した(図1)。このことは、活性中心から離れたサブサイトが基質認識だけでなく酵素の反応機構にも協奏的な作用を及ぼしていることを示している。 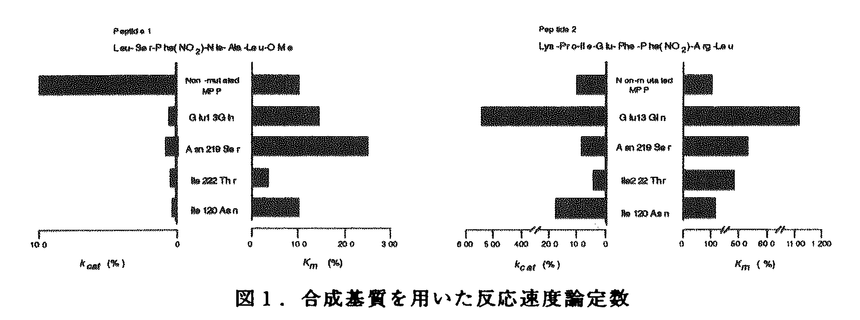 図1.合成基質を用いた反応速度論定数(2)S3サブサイトを構成しているGlu13及びAsn219残基の解析 図1.合成基質を用いた反応速度論定数(2)S3サブサイトを構成しているGlu13及びAsn219残基の解析 Glu13とAsn219をさらに詳細に解析するために、部位特異的変異によりGlu13をGLn、Asp、Asn、Lys、Alaに、Asn219をGln、Serに置換した変異型MPPを作製し、2種類の合成基質を用いて反応速度論的解析を行った。その結果、両残基の各変異型MPPは基質1でkcatが著しく減少していた。このことは、活性中心から離れたS3サブサイトが酵素-基質複合体のコンホメーション変化を通じて、あるいは酵素の他の残基を通じて間接的に触媒反応に関与していることを強く示唆している。また、アスパラギン酸プロテアーゼの基質の中でP3部位の違いによってkcatが著しく変化する現象は、こうした残基の寄与によるものだと考えられる。各変異型酵素のインシュリンB鎖に対する切断特異性を解析した結果、特にAsn219Ser変異体が、219番残基にSerをもつペプシン型にその切断特異性が変化した。このことから、219番残基が基質特異性を決定する重要な残基の一つであることが明らかになった。 (3)Thr218とAsn303の機能の解析(レニンとの比較から) アスパラギン酸プロテアーゼでは、ペプシンのpH2からレニンのpH7まで、至適pHに大きな差があることが知られている。そこで、至適pHが中性であるレニンだけでアミノ酸が異なっている部位に着目し、MPPのその部分をレニン型に改変したThr218Ser,Asn303Ala及びキモシン型に改変したAsn303Aspを作製した。S2を構成する残基の変異体Thr218Serの酸変性ヘモグロビンに対する至適pHは約0.5低下した。Asn303Alaでは変化はないが、303Aspでは約0.5上昇した。これらの結果は、レニンの至適pHがこれらの部位だけによって決定されているのではないことを示している。303番の変異体は凝乳活性とプロテアーゼ活性が1/10に低下しており、合成基質を用いた反応速度論定数も極端に変化した。以上の結果は303番部位がX線結晶解析からS2周辺であるが、直接基質と相互作用はしない位置にあるにもかかわらず、酵素反応に重要な働きをもっていることを示している。303番から活性中心の32番までの水素結合のネットワークが、32番Aspのヒドロキシル基のイオン化へ寄与するよりも活性中心付近のコンホメーションの維持に寄与することが考えられる。 (4)安定性に関与しているアミノ酸残基の解析 S2’のTrp190Phe、S3のGlu12Thr、S2のThr218Serでは凝乳活性の耐熱性が著しく減少しており、55℃、3時間後で野生型MPPでは残存活性が90%以上あるのに対してTrp190Phe、Glu12Thrでは10%以下、Thr218Serでは40%前後を示した。こうした熱による安定性の低下は変異型酵素の自己消化によって起こることが確認され、これらの残基が蛋白質の構造維持に寄与していることが明かになった。自己消化の機構は野生型MPPのアルカリでの分解と同じようにN末端の構造喪失に起因することが明らかになった。また、これまでの知見を基にして作製した2重変異型酵素Tyr75Asn/Trp190Pheでは耐熱性が大きく減少しており、凝乳酵素の性能を表わす1つの指標となる凝乳活性とプロテアーゼ活性の比も2.6倍上昇し、実用上有用な凝乳酵素の作出に成功した。 II.フラップ(flap)領域に存在するTyr75の機能解析(1)Tyr75残基の酵素活性機構への寄与 全てのアスパラギン酸プロテアーゼで保存されている75番Tyrは、基質結合クレフトを覆うような形で存在する自由度の高いフラップ領域に位置しており、基質認識に重要な働きをするS1サブサイトを構成する残基の一つと考えられている。 Tyr75を他の19種類のアミノ酸に置換した変異酵素を作製したところ、Tyrと同様な芳香族アミノ酸であるPheとTrpへの改変だけでなく、Asnへの改変によっても十分活性が保持されている事が明らかになった。その他の変異体では野生型MPPの1/1000以下の微弱な活性を示した。一方、基質類似の特異的阻害剤であるペプスタチンとの相互作用を紫外部の差スペクトル法により検出を試みたところ、野生型と十分活性が保存されているTyr75Asnは、三つのピークを持つスペクトルを示しているが、Tyr75Pheと1/1000、1/5000の活性を示すTyr75Ser、Tyr75Proの変異体では二つのピークを持つスペクトルを示しており、さらに両者とも差スペクトルのペプスタチン濃度依存性から、酵素と阻害剤が1対1で結合していることが明らかになった。微弱な活性を持つその他の変異体では、差スペクトルの検出ができなかった。以上の結果は、75番部位の残基の置換は、基質結合に直接影響を及ぼすと同時に反応遷移状態の安定化に非常に大きな影響を与え、活性を低下させていることを示している。また、Tyr75Asn酵素の反応機構は図2のようにAsnのアミド基と基質のP1との水素結合による遷移状態の安定化によるものと推定される。 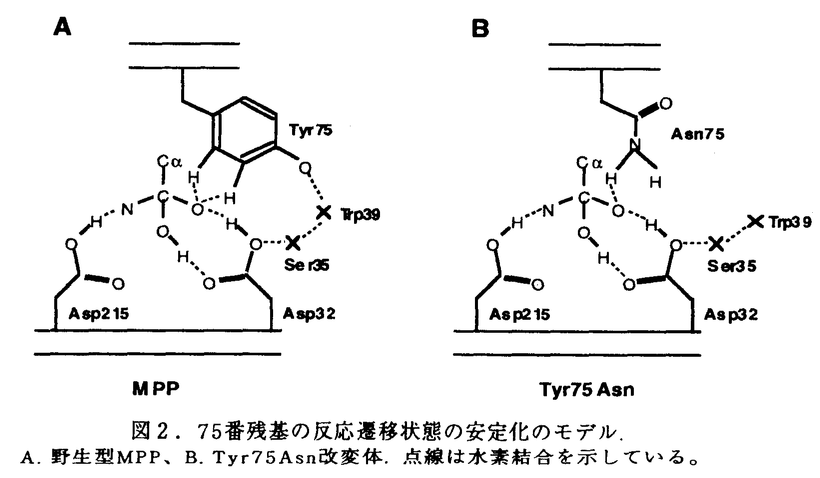 図2.75番残基の反応遷移状態の安定化のモデル.A.野生型MPP、B.Tyr75Asn改変体.点線は水素結合を示している。(2)Tyr75Asn変異体酵素の糖鎖付加と活性への影響 図2.75番残基の反応遷移状態の安定化のモデル.A.野生型MPP、B.Tyr75Asn改変体.点線は水素結合を示している。(2)Tyr75Asn変異体酵素の糖鎖付加と活性への影響 75番TyrのAsnへの改変によりAsn型糖鎖の付加配列(Asn-Xaa-Thr)が新たに生じる事から、Asn75に糖鎖が付加されその糖鎖が活性に関与する可能性が予想された。Tyr75Asnに加えてAsn72とAsn171の両者もしくはどちらか一方をGlnに置換した改変体を作製し、糖鎖付加の有無と酵素活性への影響を調べた。その結果、75番をAsnにした変異を有するものでは分子量が大幅に増大していた。高分子量のMPPはendoH処理により糖鎖付加をされていないものの分子量に変換したことから、これらの改変酵素にハイパーマンノース型の糖鎖が付加されていることが明らかになった。また、Asn72/Asn75/Asn171(RS4)において3箇所の糖鎖付加部位のうちの2箇所ずつ、Asn72/Asn75/Gln171(RS5)において2箇所の糖鎖付加部位のうちの1箇所ずつのハイパーマンノース型と短い糖鎖が付加されていることが明らかになった。改変酵素のendoH処理後の活性を調べたところ、RS4とRS5では十分な活性が検出される一方、Asn75に糖鎖が付加されているAsn72/Asn75/Gln171とGln72/Asn75/Gln171では微弱な活性しか検出できなかった。活性が検出されたRS4とRS5では、Asn75に糖鎖が付加されている分子種と糖鎖が付加されていない分子種があることから、糖鎖が付加されていない分子種を完全精製し活性を調べた。その結果、Tyr75AsnはインシュリンB鎖に対する基質認識やヘモグロビンを基質としたプロテアーゼ活性のpHプロフィールは野生型MPPと同じものの、凝乳活性が2.3倍、基質特異性は1.9倍増加していた。一方、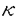 -カゼインをモデルとした合成基質での反応速度論的解析ではkcatが著しく増加した。 -カゼインをモデルとした合成基質での反応速度論的解析ではkcatが著しく増加した。 (3)Tyr75とTrp39との分子内の相関関係の解析 Tyr75は全てのアスパラギン酸プロテアーゼで保存されており、Trp39と水素結合し、基質のP1と相互作用できるように構造的な安定性を維持していると考えられる。Trp39を他のアミノ酸に改変し、酵素活性への影響や構造の安定性との関連について調べた。Trp39をAsn、Cysに改変し、Tyr75との水素結合をなくした変異体酵素を作製し、酵母で分泌発現させ、2種類の合成基質を用いて、反応速度的解析を行った。その結果、MPPの基質である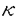 -カゼインに類似する合成基質でkcatが著しく変化した。この結果はTyr75の変異体酵素の反応速度的解析と同じ結果であり、Tyr75-Trp39の水素結合が酵素活性に重要であることを示している。また、Tyr75AsnとTrp39Asn変異体酵素の耐熱性は著しく減少しており、Tyr75-Trp39の相互作用がMPPの構造維持に寄与していることが明らかとなった。 -カゼインに類似する合成基質でkcatが著しく変化した。この結果はTyr75の変異体酵素の反応速度的解析と同じ結果であり、Tyr75-Trp39の水素結合が酵素活性に重要であることを示している。また、Tyr75AsnとTrp39Asn変異体酵素の耐熱性は著しく減少しており、Tyr75-Trp39の相互作用がMPPの構造維持に寄与していることが明らかとなった。 以上のように、本研究で得られたMPPの構造-機能の相関関係や構造安定化に対する知見を基に、今後アスパラギン酸プロテアーゼの詳細な触媒機構及び基質認識が解明され、さらに実用的にも応用できる蛋白質の設計にも応用されることが期待される。 |