アルツハイマー病(Alzheimer’s disease;AD)を特徴づける主要な病理学的な所見は、老人斑と神経原線維変化(neurofibrillary tangle;NFT)である。この中でNFTは神経細胞の脱落、痴呆の程度と深い関係がある異常構造物であると考えられている。NFTは電顕的に、paired helical filament(PHF)とよばれる単位線維の束からなっており、微小管結合蛋白質のひとつであるtauが主要構成成分である(PHF-tau)。PHF-tauは正常tauにはみられない異常なリン酸化を受けていることが知られている。tauは発達段階でリン酸化の程度が異なり、胎児期では成熟期よりもリン酸化をうけており、微小管の安定化および重合促進といったtauの機能はリン酸化によって調節されるらしい。リン酸化依存性にPHFを認識する多くの抗体が、胎児型tauも認識することから、両者は共通のリン酸化エピトープをもつことがわかった。このように、発達段階にある胎児のtauと変性しつつある脳内のPHF-tauのリン酸化状態に類似性があることは興味深いことである。また、形態的にPHFの束からなるneuropil threadの観察から、PHFの周囲には正常の細胞骨格はほとんど存在しないことが見いだされ、異常リン酸化されたPHF-tauにtau本来の機能が保持されているか否かを調べることは、PHF形成過程を考える上で重要な知見を与えると思われた。本研究では、PHF-tauおよび胎児型tauの微小管重合能および結合能の測定を行ない、PHF-tauと胎児型tauにおけるリン酸化の相違について検討を行った。 材料と方法 PHF-tauはAD脳Sarkosyl不溶性画分から、胎児型、成熟型および正常tauはそれぞれ生後1日齢、12週齢ラットおよび健常者脳可溶性画分より調製した熱安定性画分からゲルろ過、逆相HPLCにより精製した。チューブリンは、重合-脱重合のサイクルを2回繰り返して得た微小管を脱重合した後、ホスホセルロースカラムにかけ、その未吸着画分に回収し(PCチューブリン)、これを使用した。 tauの脱リン酸化には、10 U/mlアルカリホスファターゼ(Ecoli,type III)、プロテアーゼ阻害剤を含む50mM Tris-HCl(pH8.3)緩衝液中で67℃、2時間行った。cAMP dependentprotein kinase(PKA)による胎児型tauのリン酸化は、200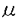 gの胎児型tauを用い、250U/ml catalytic unitを含んだ緩衝液[20mM MES(pH6.7),10 mM MgCl2,1mM DTTおよび0.2mM ATP]中にて30℃、15時間行った。TPK I(tau protein kinase I)/TPK II(tau protein kinase II)による胎児型tauのリン酸化は、200 gの胎児型tauを用い、250U/ml catalytic unitを含んだ緩衝液[20mM MES(pH6.7),10 mM MgCl2,1mM DTTおよび0.2mM ATP]中にて30℃、15時間行った。TPK I(tau protein kinase I)/TPK II(tau protein kinase II)による胎児型tauのリン酸化は、200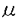 gの胎児型tauを250 gの胎児型tauを250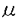 lの緩衝液[100mM MES(pH 6.5),1 mM sodium acetate,1 mM EGTA,0.525 mM ATP,5mM 2-mercaptoethanol,10% glycerol,0.02% Tween 20,0.01% sodium azide,26 lの緩衝液[100mM MES(pH 6.5),1 mM sodium acetate,1 mM EGTA,0.525 mM ATP,5mM 2-mercaptoethanol,10% glycerol,0.02% Tween 20,0.01% sodium azide,26 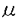 g/ml TPK I,4.1 g/ml TPK I,4.1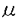 g/ml TPK IIおよびプロテアーゼ阻害剤]中にて37℃、16時間反応させた。 g/ml TPK IIおよびプロテアーゼ阻害剤]中にて37℃、16時間反応させた。 tauの微小管重合促進能の測定は、350nmにおける濁度変化より求めた。0.1mg/mlのtauを含む重合緩衝液[0.1 M MES(pH6.5),1 mM EGTA,0.5 mM MgCl2,1 mM DTTおよび1 mM GTP]に種々の濃度のPCチューブリンを加え、37℃にて加温し、30分後の濁度を重合能を示す値とした。tauの微小管結合能はタキソール微小管を用いて調べた。一定濃度のタキソール微小管に一定量、あるいは濃度を変えたtauを加え、37℃にて15分間加温し、遠心により、沈渣に微小管結合tau、上清に非結合tauを分画し、それぞれに含まれるtauをSDS電気泳動後、coomassie brilliant blue染色により検出し、デンシトメーターによる定量(PDI,Quantity OneTM;TOYOBO)、あるいは抗tau抗体を用いてイムノプロット法による解析を行なった。Kdは、以上の定量値を用いて回帰曲線分析(KaleidaGraph;Abelbeck Soft)あるいはScatchard plotにより求めた。 結果と考察 PHF-tau、胎児型tau、正常tauおよび成熟型tauの微小管重合促進能を、0.1mg/mlのtauおよび1.0mg/mlチューブリンの存在下で調べた結果、正常tauおよび成熟型tauに比べ、胎児型tauはその70〜80%の重合促進能を保持していたが、PHF-tauはほとんど重合促進能をもたなかった。つぎに、それぞれのチューブリン重合の臨界濃度を求めたところ、PHF-tauでは1.4〜1.6mg/ml、胎児型tauでは0.3〜0.4mg/ml、正常tauおよび成熟型tauでは0.1〜0.2mg/mlとなり、胎児型tauでは正常tauおよび成熟型tauの約2倍であるのに対して、PHF-tauでは約8倍と異常に高い値となり、チューブリンのみのときの臨界濃度が1.8〜2.0mg/mlであることから、PHF-tauの重合促進能はかなり低いか、もしくはほとんどないと考えられた。脱リン酸化したPHF-tauおよび胎児型tauの微小管重合促進能は正常tauおよび成熟型tauのそれに近い値を示した。 PHF-tauおよび胎児型tauの上記の性質が、微小管に対する親和性に起因するものかを検討するために、タキソール微小管に対する結合能を求めた。その結果、タキソール微小管濃度0.5mg/ml、tau濃度0.05mg/mlの条件下では、胎児型tauはそのほとんどが微小管結合画分に回収されたので、微小管結合能をもつと考えられ、これに対して、PHF-tauはそのほとんどが微小管非結合画分に回収されたので、その微小管結合能もかなり低いものと考えられた。また、胎児型tauのKdは約0.38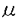 Mと求められたのに対して、PHF-tauは微小管結合画分にほとんど回収されないことから、そのKdは正確に求められなかった(グラフからは少なくとも10 Mと求められたのに対して、PHF-tauは微小管結合画分にほとんど回収されないことから、そのKdは正確に求められなかった(グラフからは少なくとも10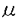 M上とみられた)。さらに、PHF-tauの微小管結合能は脱リン酸化後、回復した。したがって、PHF-tauの微小管結合能は胎児型tauに比べ異常に低いと考えられ、両者の重合促進能の差は、微小管に対する親和性の差に基づくものと考えられた。 M上とみられた)。さらに、PHF-tauの微小管結合能は脱リン酸化後、回復した。したがって、PHF-tauの微小管結合能は胎児型tauに比べ異常に低いと考えられ、両者の重合促進能の差は、微小管に対する親和性の差に基づくものと考えられた。 次に、胎児型tauをPKAおよびTPK I/TPK II(TPK IとTPK II)によりリン酸化した場合を検討した。その結果、チューブリン重合の臨界濃度は、各々1.2〜1.4、1.1〜1.4mg/mlとなり、PHF-tauのそれと近い値であることから、PKAおよびTPK I/TPK IIによりリン酸化した胎児型tauの微小管重合促進能は、PHF-tauのそれとほぼ同様にかなり低いと考えられた。 以上のように、PHF-tauと胎児型tauのリン酸化は類似しているにもかかわらず、後者には微小管重合促進能、結合能がみられるが、前者にはそれらがほとんどみられない。すなわちPHF-tauが細胞質にモノマーとして存在したとしても、微小管とは全く相互作用しないといえる。PHF-tauの機能喪失は脱リン酸化によって完全に回復するので、胎児型tauと比較してリン酸化の程度が高いためと考えられた。確かに胎児型tauをPKAおよびTPKI/TPKIIでリン酸化するとPHF-tau様の微小管重合促進能の喪失をきたす。 リン酸化の程度の違いは細胞内環境の違いを反映しており、とくに胎児型リン酸化以上のリン酸化が何故おこるのかを明らかにすることが重要なことと思われる。 まとめ 1.胎児型tauは正常tauあるいは成熟型tauと比べ、微小管重合促進能は低いものの、これを保持しているのに対して、PHF-tauは微小管重合促進能をほとんど喪失していることが示された。 2.脱リン酸化した胎児型tauおよびPHF-tauの微小管重合促進能は、正常tauとほぼ同じ程度まで回復することが示された。 3.胎児型tauとPHF-tauの微小管重合促進能の違いは、微小管に対する親和性に起因することが示された。 4.PKAあるいはTPK I/TPK IIを用いて胎児型tauをリン酸化した場合、PHF-tau様の微小管重合促進能の喪失がみられた。 5.本研究で示されたPHF-tauと胎児型tauの微小管重合促進能の違いはリン酸化状態の差と考えられた。 |