| 内容要旨 | | 1.はじめに 小脳における長期抑圧(LTD)は、Purkinje細胞(PC)への2つの興奮性入力系である顆粒細胞由来の平行線維(PF)と下オリーブ核からの登上線維(CF)の同時興奮により、PF・PC間のシナプス伝達効率が長期間低下する現象であり、小脳における運動学習の細胞レベルでの基礎過程と考えられている。LTD誘導にはPFとCFからのPCへの同時入力が必要で、後者はPCの脱分極によっても代替可能である。このことはPCの電位依存性Ca2+チャンネル(VGCC)からのCa2+流入がLTD誘導に必要であることを意味する。またPF入力はglutamate(Glu)がその神経伝達物質であるが、これによるPCの樹状突起上のAMPA受容体、及びmetabotropic Glu受容体(mGluR)の活性化がLTD誘導に必要であり、特にmGluRに関しては、その活性を阻害する抗体による実験や、ノックアウト・マウスを用いた研究により、LTD誘導にはmGluRタイプ1(mGluR1)の活性化を必要とすることが報告されている。mGluR1活性化の下流ではinositol 1,4,5-trisphosphate(IP3)の産生とdiacylglycerolを介するprotein kinase C(PKC)の活性化が起こるが、このPKCの活性化がLTDには必要であることが示されている。 小脳PCは細胞内Ca2+ストアの観点からも特異な細胞である。IP3受容体(IP3R)タイプ1がPCには圧倒的に多く発現し、また現在知られているすべてのタイプのryanodine受容体(RyR)も発現しており、特に骨格筋タイプのRyRはニューロンにおいてはPC特異的である。これら細胞内Ca2+ストア上の受容体・チャンネルはそれぞれIP3誘導Ca2+放出(IICR)、Ca2+誘導Ca2+放出(CICR)に寄与するが、シナプスの可塑性を含め、ニューロンの生理的機能においてその役割は明確でない。 本研究では、PCのLTDにおける細胞内Ca2+ストア、特にryanodine(Ry)感受性Ca2+ストアからのCa2+放出の役割について、小胞体上のCa2+-ATPaseを特異的に阻害するthapsigargin(Tg)及び、RyRの阻害剤であるRy,ruthenium red(RR)を用いて検討した。 2.方法(1)初代培養系 本研究は小脳ニューロンの初代培養系を用いて行った。妊娠17-18日目のICRマウスから、ether麻酔下、帝王切開により胎仔を取り出し、小脳を摘出、軟膜を剥離する。trypsin処理の後、DNase I添加メディウムにてピペッティングにより、組織をほぐす。poly-L-lysineコートしたカバー・ガラスに細胞を2x105cells/cm2の濃度にてまき、無血清培地で2-3週間培養すると、PCは形態学的に容易に他の細胞と判別可能となる。 (2)電気生理学的実験 培養16-26日のPCをホールセル膜電位固定し、Gluはiontophoresisによって樹状突起に投与した。電極内溶液の組成は(以下mM)、140K-gluconate,7KCl,2MgCl2,0.5EGTA,4Na-ATP,0.3Na-GTP,10HEPES(pH7.35)、また細胞外液は150NaCl,5KCl,2CaCl2,0.8MgCl2,10HEPES,10 glucose(pH 7.35)に、1 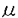 M tetrodotoxinと10 M tetrodotoxinと10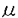 M bicucullinを添加した。データには、静止膜電位が45mV以下、シリーズ・レジスタンスの変化が25%以内の場合のみを採用した。測定は全て室温にて行った。 M bicucullinを添加した。データには、静止膜電位が45mV以下、シリーズ・レジスタンスの変化が25%以内の場合のみを採用した。測定は全て室温にて行った。 LTDの誘導には、まずPCを-80mVに電位固定し、Glu投与(0.05Hz、投与時間は100msec)によって生じる内向き電流を一定時間測定。これが安定した後、Glu投与に合わせてPCを1 sec脱分極する(同時刺激)。12回繰り返した後は、Glu投与のみを行い、内向き電流の変化を記録する。 Tg,Ryは細胞外液に添加し、RRはパッチ電極から投与した。 電位依存性Ca2+電流の測定には、電極内溶液はK-gluconateをCsClに換え、さらに細胞外液には10mM tetraethylammonium chloride、1mM 4-aminopyridineを加えた。 (3)Microfluorometry Ryは細胞内濃度がnMにてはCICRを増強し、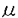 Mでは抑制する。これまでの報告でも、実験系によってその抑制する濃度に差が見られるため、本研究のLTDの実験に用いたRyの濃度でCa2+放出が抑制されるかを確認する実験を行った。培養細胞を10 Mでは抑制する。これまでの報告でも、実験系によってその抑制する濃度に差が見られるため、本研究のLTDの実験に用いたRyの濃度でCa2+放出が抑制されるかを確認する実験を行った。培養細胞を10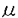 M fura-2AMを添加した細胞外液で37℃、1時間インキュベートし、通常の細胞外液にて洗った後、高K+溶液、及び10mM caffeine(Caf)に対するPCの細胞体における蛍光強度の変化をRy存在下、非存在下でSITカメラにより測定した。 M fura-2AMを添加した細胞外液で37℃、1時間インキュベートし、通常の細胞外液にて洗った後、高K+溶液、及び10mM caffeine(Caf)に対するPCの細胞体における蛍光強度の変化をRy存在下、非存在下でSITカメラにより測定した。 3.結果(1)LTDの誘導 上述したプロトコールでは、7例中6例においてGlu投与によって生じる内向き電流のピーク値の持続的減少が観察された。同時刺激後20minの内向き電流のピーク値は同時刺激前に較べ、66.3±4.8%(平均±標準誤差、n=7)であった。 (2)LTDのTg,Ry,RRによる阻止 LTDの誘導における細胞内Ca2+ストアからのCa2+放出の役割を検討するため、Tg,Ry,RR投与下で(1)と同様の実験を行った。Tg,Ryは、それぞれ5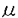 Mを添加した細胞外液で10minインキュベートした後、同時刺激を行った。RR(20 Mを添加した細胞外液で10minインキュベートした後、同時刺激を行った。RR(20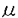 M)はパッチ電極より投与した。 M)はパッチ電極より投与した。 Tgは6例中5例において、Ry,RRはそれぞれ5例全例においてLTDの誘導が阻止された。同時刺激後20 minの内向き電流のピーク値は同時刺激前の106.5±4.1%(n=6),116.1±6.6%(n=5),114±1.6%(n=5)と、むしろ増強していた。 (3)Tg,Ryの電位依存性Ca2+電流、及びGlu投与による内向き電流に対する影響 Tg,RyがLTD誘導を阻止したことが、電位依存性Ca2+電流やGlu投与による内向き電流そのものに対する効果のためでないことを示すため、上記薬物投与の前後で、電位依存性Ca2+電流と内向き電流の大きさを比較した。投与後10minでは投与前に対し、それぞれ、Ca2+電流は、101.9±3.3%(n=4),103.9±2.8%(n=6)、内向き電流は、101.8±1.8%(n=4),101.4±2.3%(n=5)で、有意差は見られなかった。 (4)5 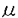 M Ryの細胞内Ca2+放出への効果 M Ryの細胞内Ca2+放出への効果 Ry投与後3 minでは10mM Cafへの反応は、1度目のCaf投与に対してはRy投与前に較べて減弱し、2度目では反応が見られなかった(n=5)。従って、本実験系では5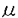 M RyでCa2+放出は阻害されることが示された。 M RyでCa2+放出は阻害されることが示された。 4.考察 本研究において、Tg,Ry,RRはいずれもLTDの誘導を阻止し、それ自体はLTDの誘導に必要な電位依存性Ca2+電流に影響を与えず、Gluによる内向き電流に対しても変化をもたらさなかった。これはLTDの誘導に細胞内Ca2+ストアからのCa2+放出、特にRy感受性プールからのCa2+放出をを必要とすることを示唆している。 Tgは小胞体に存在するCa2+-ATPaseを阻害し、細胞内Ca2+ストアを枯渇させることでIICR,CICRを阻害する。海馬ニューロンにおいてもTgはNMDA受容体からのCa2+流入によって生ずるCICRを阻害し、またTgは海馬における長期増強の誘導を阻止する。本実験の結果は小脳におけるLTDの誘導にも、細胞内Ca2+放出が必要であることを示唆している。 Ry及びRRはRyRをブロックすることでCICRを阻害する。Ryは上述したように、系によってCa2+放出を抑制する濃度が異なるが、microfluorometryによって、本研究のLTDの実験に用いたRy濃度でCa2+放出が阻害されることが示された。以上の結果はLTD誘導にRy感受性プールからのCa2+放出が必要であることを示唆している。 PCにおいては脱分極によるVGCCからのCa2+流入でCICRを生じることが観察されている。本実験においてLTD誘導に関与が示唆されたCICRはこのメカニズムによることが考えられるが、PFの入力によっても樹状突起で局所の脱分極により細胞内Ca2+濃度が上昇することが報告されている。局所のCa2+上昇においてもCICRが生じ、このCICRがLTD誘導の過程に関わっていることも考えられる。 IICRもPCにおいて観察されている。Tgは細胞内Ca2+ストア全般を枯渇させるので、本研究においても、IICRをも阻害してLTD誘導を阻止したことも考えられる。実際、LTDの誘導にIICRが必要であることを示唆する報告もある。IICRとCICRはCa2+シグナルを増幅するために互いに影響し合い、またCa2+は細胞内メッセンジャーとしては細胞内に存在する多量のCa2+バッファーのためにその作用時間、距離が他のセカンド・メッセンジャーに較べ、小さい。従って、CF,PFからのシグナルがIICR,CICRによって増幅されることが、その後のLTD誘導の細胞過程を進める上で必要であると考えられる。 |
| 審査要旨 | | 小脳プルキニェ細胞への2つの興奮性入力(顆粒細胞由来の平行線維と下オリーブ核からの登上線維)を同時に興奮させると、平行線維・プルキニェ細胞間のシナプス伝達効率が長期的に低下する。この現象は長期抑圧と呼ばれ、小脳における運動学習の基礎過程と考えられている。本研究は、長期抑圧への細胞内Ca2+ストアからのCa2+放出の関与を明らかにするため、マウス小脳初代培養系を用いて薬理学的解析を行ったものである。下記の結果を得ている。 1.マウス初代培養系のプルキニェ細胞を全細胞定電圧固定し、プルキニェ細胞の脱分極と電気泳動によるL-グルタミン酸投与という2つの刺激を与えた。この同時刺激によって、L-グルタミン酸投与で生じる内向き電流の振幅が、20分以上にわたって減少する長期抑圧が誘導された。同時刺激後20分の内向き電流は、同時刺激前の66.3%±4.8(n=7)であった。 2.小胞体上のCa2+-ATPaseの阻害剤であるタプシガルギン存在下では長期抑圧は誘導されなかった(同時刺激後20分の内向き電流は刺激前の106.5%±4.1(n=6))。またリアノジン・レセプターの阻害剤であるリアノジン、ルテニウム・レッドも長期抑圧の誘導を阻止した(同様の条件で、それぞれ116.1%±6.6(n=5)と114%±1.6(n=5)の内向き電流)。リアノジンは実験系によってCa2+放出を阻害する濃度が異なることが知られている。本実験で用いた濃度のリアノジンはカフェインによるCa2+放出を抑制していることが示された。これらの結果は細胞内Ca2+ストア、特にリアノジン感受性ストアからのCa2+放出が長期抑圧に必要であることを示している。 3.長期抑圧に電位依存性Ca2+チャネルを利用する細胞外からのCa2+流入が必要であると考えられている。このCa2+流入はタプシガルギンやリアノジンの投与によって変化しなかった(薬物非投与細胞でのCa2+流入量のそれぞれ101.9%±3.3(n=4)、103.9%±2.8(n=6))。また、これら薬物処理はL-グルタミン酸により引き起こされる内向き電流に対しても影響を与えなかった(それぞれ対照の101.8%±1.8(n=4)、101.4%±2.3(n=5))。これらの結果は、タプシガルギンやリアノジンがCa2+流入やL-グルタミン酸依存性内向き電流に影響し、その二次的効果として長期抑圧を阻害したという可能性を否定するものである。 従来より長期抑圧にはCa2+が重要であることが知られていたが、そのソースとしては電位依存性Ca2+チャネルからのCa2+流入が主に考えられきた。本論文では以上に述べたように、マウス小脳プルキニェ細胞の初代培養系を用いて、長期抑圧の誘導に細胞内Ca2+ストアからのCa2+放出、特にリアノジン感受性ストアからのCa2+放出が必要であることを示す実験結果を報告している。本研究は、神経細胞における細胞内Ca2+ストアの生理的役割に関し新しい知見を提供するものであり、学位の授与に値するものと判定する。 |