導入:細胞内カルシウム濃度の変化は、種々の生理現象の発現に重要な役割を果たしていると考えられている。イノシトール3リン酸(IP3)は細胞外からのホルモン等の刺激に応じて細胞内に産生されるセカンドメッセンジャーのひとつであり、イノシトール3リン酸受容体(IP3R)は、このIP3により細胞内カルシウム貯蔵部(小胞体)からカルシウムを放出するチャネルである。IP3Rとして、今までに、異なる遺伝子にコードされ、相互に相同性の高い、タイプ1、2、3という分子がクローニングされている。(以下、それぞれをIP3R1、IP3R2、IP3R3、と略記する。)IP3Rはリン酸化酵素や、アデノシン三リン酸など、多くの分子から機能調節を受けていると考えられており、細胞内カルシウム濃度調節のひとつの要となっている。 カルモジュリン(CaM)は代表的なカルシウム結合蛋白質であり、カルシウム濃度の上昇により構造変化して多くの酵素等に結合し、活性を調節することが知られている。CaMは、広い動物種で広い組織分布を持って存在しており、マウスではほとんどの臓器で数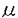 M以上の高濃度で存在している。 M以上の高濃度で存在している。 細胞膜透過処理した肝上皮由来細胞を用いた実験で、IP3によるカルシウム放出が、各種CaM阻害剤(W7、W13、CGS9343B)により抑制されることが、1988年にHillらにより報告されたが、この系でのCaMの標的分子は不明である。 一方、小脳から精製したIP3R(主としてIP3R1)がCaM-Sepharoseに結合することは既に報告されていたが、その後の解析は進んでいなかった。 IP3Rに対するCaMの作用として、ひとつは細胞内カルシウム濃度によるIP3Rのカルシウム放出活性の調節を仲介している可能性が考えられる。小脳由来の膜画分や膜透過処理した細胞を用いた実験ではカルシウム濃度0.2-0.3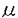 MでIP3によるカルシウム放出活性が最大となるという調節が知られている。この調節は、細胞内カルシウム濃度を適度に変動させるために大変重要なものと考えられているうえ、近年では、カルシウムオシレーションやカルシウム波の発生機序とも深く関わるものとして注目されてきている。現在まで、精製したIP3Rではこの調節は検討されておらず、IP3Rへのカルシウムの作用は、CaMを介している可能性がある。そこで、私はCaMがIP3Rに直接作用する可能性を追究するため、IP3R1上のCaM結合領域の同定や、結合の解離定数の測定をはじめとした研究を行った。 MでIP3によるカルシウム放出活性が最大となるという調節が知られている。この調節は、細胞内カルシウム濃度を適度に変動させるために大変重要なものと考えられているうえ、近年では、カルシウムオシレーションやカルシウム波の発生機序とも深く関わるものとして注目されてきている。現在まで、精製したIP3Rではこの調節は検討されておらず、IP3Rへのカルシウムの作用は、CaMを介している可能性がある。そこで、私はCaMがIP3Rに直接作用する可能性を追究するため、IP3R1上のCaM結合領域の同定や、結合の解離定数の測定をはじめとした研究を行った。 方法と結果:一般に、CaMは、標的分子中の20-30アミノ酸からなる二次構造を認識して結合する。そこで、私は、以下のように、IP3R1のCaM結合に必須なアミノ酸領域を決定した。1.マウスIP3R1のcDNA全長を培養細胞で発現させ、このIP3R1がCaMに結合することを確かめた。2.そのcDNAに制限酵素を用いて各種の部分欠失を導入して、発現させ、欠失によりCaM結合能が失われる部分を調べた。3.2.の結果から結合に必須と考えられた部分を、融合蛋白質として大腸菌で発現させ、CaM結合能を確認した。4.3.で用いた部分のcDNAを両側から削っていき、それを発現させて結合能を調べ、CaM結合能が失われない最小範囲、IP3R1,Lys1564-Arg1585を結合領域とした。この領域は、他のCaM結合蛋白質のCaM結合領域と同様に複数の塩基性アミノ酸を含む両親媒性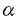 -ヘリックス構造を取り得る。なお、CaM結合能は、CaM-Sepharoseカラムへのカルシウム依存性結合を指標とした。 -ヘリックス構造を取り得る。なお、CaM結合能は、CaM-Sepharoseカラムへのカルシウム依存性結合を指標とした。 このCaM結合領域中には、Trp残基が存在している(Trp1576)が、Trp残基は多くのCaM結合タンパク質において、結合に必須であることが示されている。そこで、Trp1576をAlaに置換したIP3R1cDNAを、クンケル法により作製し、その、変異IP3R1の全長を培養細胞で発現させ、CaM結合能をみた結果、結合能が失われていた。これにより、Trp1576がIP3R1のCaM結合に必須であり、このTrpを含む領域がIP3R1の中で唯一のCaM結合領域であることが示された。 次に、結合領域(Lys1564-Arg1585)に相当するペプチドを合成し、CaMとの解離定数を以下のように測定した。アミノ酸置換の実験において、Trp1576がIP3R1のCaM結合に必須であることが示されたので、このペプチドのTrp残基が持つ蛍光は、CaMと結合した状態では変化することが予想された。実際に測定したTrp残基の蛍光は、ペプチド溶液中のCaM濃度を上昇させるにつれて、短い最大蛍光波長と高い蛍光強度をもつスペクトルに変化する事が確認できた。この変化を利用してペプチドとCaMの解離定数を求めたところ、カルシウム存在下では、0.7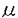 M、非存在下では、0.1mM以上と求められた。 M、非存在下では、0.1mM以上と求められた。 一方、IP3R1のCaM結合領域をもとに、他のタイプのIP3RのCaM結合能についても以下のように明らかにした。IP3R2分子中の、IP3R1のCaM結合領域に相当する位置のアミノ酸配列(Lys1565-Arg1587)は、IP3R1と相同性が高いことから、IP3R2でもこの領域がCaM結合能を有すると予想された。そこで、この領域を含むIP3R2の一部、Gln1558-Ala1596をコードするcDNAをPCR法によりクローニングし、融合蛋白質として大腸菌で発現させたところ、この融合蛋白質はCaM結合能を示した。一方、IP3R3では全長にわたって、IP3R1のCaM結合領域との有意な相同性はみられない。そこで、IP3R3のcDNA全長を培養細胞に発現させて調べた結果、IP3R3はCaM結合能を持たないことが明らかになった。 次に、IP3R1のCaM結合領域に相当するペプチドを、ウサギに免疫して抗血清を得た。この抗血清のIgG画分は、イムノブロットにより小脳膜画分中IP3Rと特異的に反応することが確認された。さらに、このIgG画分は小脳IP3R1のCaM結合を阻害した。そこで、CaM結合によるIP3Rの機能調節の可能性を探るため、小脳膜画分からのIP3誘導カルシウム放出へのこの抗体の効果を見たところ、阻害効果が見られた。 考察:本研究からは、まず、CaM結合領域の位置に関する情報が得られた。IP3R1には、cAMP依存性リン酸化酵素(PKA)によりリン酸化される部位が二箇所知られており、CaM結合領域(Lys1564-Arg1585)の近傍にそのうちの一つがある(Ser1588)。PKAによるリン酸化は、肝細胞など多くの系で、IP3によるカルシウム動態に影響することがわかっている。一方、いくつかののCaM結合タンパク質において、CaM結合とその近傍のアミノ酸のPKAによるリン酸化は、互いに抑制するなどの相互作用が存在することが知られている。IP3R1においても同様の相互作用の可能性が考えられる。 また、本研究を通して、IP3Rの3つのタイプ間でのCaM結合の差が明らかになった。IP3R1、IP3R2の間では、分子全体の中でほぼ同じ位置にCaM結合能をもつ構造が保存されている一方、IP3R3は、相当する位置が全く異なった一次構造になっており、全長でもCaM結合能を持たない。また、IP3R1では、CaM結合領域のごく近傍にPKAによるリン酸化部位が存在している一方、IP3R2では、その部位に相当する付近のアミノ酸配列は、全く保存されておらず、リン酸化され得ない。これらのことは、IP3RがCaMとリン酸化によりタイプごとに違った調節を受けている可能性を示唆している。IP3Rの各タイプでは調節機構等の差異が今までほとんど明らかになっておらず、CaM結合やリン酸化部位の差は、各タイプの生理的機能の分担を考える際に重要な示唆を与えるものである。IP3によるカルシウム放出に関しては、実験に用いる細胞や組織の種類によって、カルシウムやPKAによる異なった調節機構があることが示唆されてきており、IP3Rのタイプ間での差が、この多様性を生み出すひとつの要素として働きうる。 本研究中、IP3R1上のCaM結合領域とCaMとの解離定数が求められたので、それをもとにIP3R1とCaMが細胞内で結合している可能性を推測できる。小脳ではCaMの濃度が高く、可溶性画分中の小脳平均でのCaM濃度が約19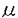 M(19 M(19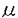 mole/litre of tissue)であるとの報告がある。さらに、IP3R1もCaMも、ともにプルキンエ細胞に局在しシナプス後膜近くの滑面小胞体様構造に多く存在することも免疫電顕や生化学的分画などで調べられている。小脳プルキンエ細胞内では、神経伝達に伴いカルシウム濃度が上昇するので、その際CaMは、0.7 mole/litre of tissue)であるとの報告がある。さらに、IP3R1もCaMも、ともにプルキンエ細胞に局在しシナプス後膜近くの滑面小胞体様構造に多く存在することも免疫電顕や生化学的分画などで調べられている。小脳プルキンエ細胞内では、神経伝達に伴いカルシウム濃度が上昇するので、その際CaMは、0.7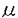 Mという解離定数から考えて、IP3R1に結合して何らかの作用を及ぼしていると考えられる。 Mという解離定数から考えて、IP3R1に結合して何らかの作用を及ぼしていると考えられる。 また、IP3R1のCaM結合領域に対する抗体によって、IP3誘導カルシウム放出が阻害されることが、本研究により示されたことから、CaMがIP3Rに直接、結合することで、カルシウム放出活性という機能を調節をしている可能性が示唆された。 |