学位論文要旨
| No | 112016 | |
| 著者(漢字) | 細山田,真 | |
| 著者(英字) | ||
| 著者(カナ) | ホソヤマダ,マコト | |
| 標題(和) | グルタミン酸トランスポーター遺伝子ファミリーと類似の構造をもつナトリウム依存性中性アミノ酸トランスポーター遺伝子のラット腎からのクローニングと機能発現 | |
| 標題(洋) | Cloning and Expression of Na+-Dependent Neutral Amino Acid Transporter from Rat Kidney with Structural Similarity to the Glutamate Transporter Gene Family. | |
| 報告番号 | 112016 | |
| 報告番号 | 甲12016 | |
| 学位授与日 | 1996.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 博医第1072号 | |
| 研究科 | 医学系研究科 | |
| 専攻 | 第二基礎医学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | [序文]ラットの腎臓において生理的濃度のグルタミン酸は、皮質表層部にある近位尿細管迂曲部の最初の3分の2まででほとんど再吸収されることが、既知濃度のアミノ酸溶液でin vivoの尿細管管腔内を灌流するfree-flow microperfusionの実験で明らかにされている。今までクローニングされたグルタミン酸の輸送機能を発現するcDNAクローンのなかで、腎臓において発現が見られるのはEAAC1だけであるが、EAAC1のラット腎臓内局在についてはin situ hybridization法によって髄質外層外帯に局在することが示されている。したがってラット腎皮質表層にはEAAC1は存在しないので、この部位におけるグルタミン酸の輸送を担う、EAAC1とは別のグルタミン酸トランスポーターが管腔側に存在することが予測される。このラット腎皮質表層でグルタミン酸の輸送を担うグルタミン酸トランスポーターをクローニングすることを本研究の目的とした。現在までに得られた哺乳類のナトリウム依存性のグルタミン酸トランスポーターはウサギ小腸から得られたEAAC1とラット脳から得られたGLASTとGLT-1の3つが報告されている。それぞれ51%〜55%のDNA配列の類似を認め、ひとつの遺伝子ファミリーを形成している。従ってこの目的とするグルタミン酸トランスポーターも同じ遺伝子ファミリーに属している可能性があり、もしファミリーに属していればDNA配列の類似性を利用してクローニングできる可能性が高い。具体的にはラット腎皮質表層cDNAライブラリーを用いて、グルタミン酸トランスポーター遺伝子ファミリーとのDNA配列の類似性を利用したPCRクローニングを行った。 [方法と結果]高親和性ナトリウム依存性グルタミン酸トランスポーターEAAC1、GLT-1、GLAST、および同一の遺伝子ファミリーに属するナトリウム依存性中性アミノ酸トランスポーターASCT1においてアミノ酸配列が保存された部分を用いてdegenerated primerを合成した。ラット腎皮質表層部からセシウムトリフルオロ酢酸を用いたグアニジンチオシアン酸法により全RNAを超遠心機で分離し、オリゴ(dT)カラムを用いてpoly(A)+RNAを精製した。これよりオリゴ(dT)12-18プライマーとランダムヘキサマーを用いてcDNAライブラリーを作成し、PCR用のテンプレートとしてオリゴ(dT)12-18プライマーを用いて一本鎖cDNAを合成した。EAAC1由来のPCR生成物は制限酵素NheIによって切断されるのでPCR生成物をNheIで処理して切断されない配列を単離した。これをプローベとしてラット腎皮質表層cDNAライブラリーを60万クローン検索して陽性のcDNAを1クローン得た。 ジデオキシ法によりこのクローンは2564塩基のDNA配列を持ち、アミノ酸予想配列は557アミノ酸であり、高親和性ナトリウム依存性グルタミン酸トランスポーターと39〜43%、中性アミノ酸トランスポーターASCT1と56%のアミノ酸配列の一致があることを認めた。マウス精巣cDNAライブラリーから最近クローニングされたASCT2とは80%のアミノ酸配列の一致を認めた。さらにハイドロパシープロットもグルタミン酸トランスポーターファミリーと極めてよく似ていた。 インビトロトランスクリプション法により合成されたRNAを注入したツメガエル卵には[14C]L-グルタミン酸の取り込みは認められなかったが、ナトリウム依存性の[14C]L-アラニンの取り込みは認められ、そのKm値は93 ラットの各組織からノーザンプロッティング解析を行ったところ、肺、大腸、骨格筋に強い発現を認め、腎、心、小腸、目、脳、肝といった多くの組織に発現を認めたが、精巣では発現を認めなかった。 以上の結果より、このクローンはマウス精巣由来中性アミノ酸トランスポーターASCT2とアミノ酸配列の類似性は高いが、アミノ酸配列と輸送基質に対するKm値並びに組織分布の違いからASCT2Bと名付けた。 [考察]PCRクローニングによりラット腎皮質表層からグルタミン酸トランスポーター遺伝子ファミリーに属するものと考えられるナトリウム依存性中性アミノ酸トランスポーターASCT2Bの遺伝子を得ることができた。同じくグルタミン酸トランスポーター遺伝子ファミリーに属するナトリウム依存性中性アミノ酸トランスポーターASCT1と40〜60%アミノ酸配列の一致を認め、マウス精巣由来のASCT2とは80%のアミノ酸配列の一致を認めた。アミノ酸配列に差が大きく、ノーザンプロットによりmRNAの組織発現に違いがあることからラット腎由来のASCT2Bがマウス精巣由来のASCT2とは別のトランスポーターである可能性が示唆される。ハイドロパシープロットが類似しているEAAC1やASCT1と同じようにASCT2Bについても10回膜貫通型構造を予想することが出来る。しかしASCT2Bが実際に10回膜貫通型構造であると仮定すれば、N-結合糖鎖予想部位はAsn164、Asn215およびAsn536であり前2者は細胞外に存在することが予想できるが、もうひとつのカルポキシル基末端にあるN-結合糖鎖予想部位は細胞内にあることになるので、実際にこのトランスポーターが10回膜貫通であるのかどうかも含めてさらに詳細な検討が必要であると考えられた。 ASCT2Bを発現させたツメガエル卵へのL-アラニンの取り込み能の特徴からこのクローンはシステムASCに属するナトリウム依存性中性アミノ酸トランスポーターであると考えられた。マウス精巣由来のASCT2による輸送は電気的に中性であり、ASCT2Bによる輸送も同様であったことは輸送特性における類似性が強く示唆された。ASCT2BのKm値は93 ノーザンブロット解析では既に報告されているASCT1が脳や骨格筋や膵臓で主に発現が高く、ASCT2Bは肺に発現が高く、組織分布に差を認めた。ASCT2では精巣、肺、大腸、骨格筋に発現を認め、小腸で発現を認めなかったのに比べ、ASCT2Bでは逆に精巣に発現を認めず、小腸で発現を認めた。 現在小腸において発現が確認されている中性アミノ酸輸送システムASCに属するナトリウム依存性中性アミノ酸トランスポーターはASCT2Bだけである。小腸において中性アミノ酸輸送システムASCに属するナトリウム依存性中性アミノ酸トランスポーターは、1.酸性環境下にある管腔側において低親和性グルタミン酸トランスポーターとして機能しているトランスポーターと、2.中性環境下にある血管腔側においてL-アラニン、L-セリン、L-システイン、L-スレオニンなど分枝鎖のない中性アミノ酸を細胞内に取り込んでいるトランスポーターがあることが、酸性あるいは中性環境における管腔側膜および血管腔側の膜小胞を用いた取り込み実験で指摘されている。従ってシステムASCの機能的実体の一つであるASCT2Bの小腸における機能を明らかにするためにはまずASCT2Bが管腔側に存在するのか血管腔側に存在するのか免疫組織学的に決定し、血管腔側に存在した場合はさらに酸性環境における取り込み実験を行い、酸性環境における輸送特性を明らかにする必要がある。 一方腎臓においては中性アミノ酸輸送システムASCに属するナトリウム依存性中性アミノ酸トランスポーターの機能や局在については現在のところ全く情報がない。腎臓から得られたASCT2Bの腎臓における機能を明らかにするには同様に免疫組織学的検討がまず必要である。今回得られたASCT2Bが本研究の目的であるfree-flow microperfusion法にて明らかされたラット腎皮質表層でグルタミン酸の輸送を担うトランスポーターであるかどうかについては、in situ hybridization法あるいは免疫組織学的に腎皮質表層でのASCT2Bの発現を検討すると共に、免疫組織学的に管腔側での発現を明らかにして、さらに酸性環境下でグルタミン酸を輸送することを明らかにしなければならない。従って本研究でクローニングされたASCT2Bの腎臓における機能の解析が今後の課題である。 [結論]ラット腎皮質表層からナトリウム依存性中性アミノ酸輸送機構システムASCに属する新しいトランスポーターASCT2Bの遺伝子をクローニングした。ラット腎臓におけるナトリウム依存性中性アミノ酸輸送機構システムASCの役割の解明に大きく寄与することが期待される。 | |
| 審査要旨 | 本研究は腎臓におけるアミノ酸再吸収において重要な役割を演じていると考えられているナトリウム依存性アミノ酸トランスポーターの分子的実体を明らかにするために、ラット腎皮質表層cDNAライブラリーからグルタミン酸トランスポーター遺伝子ファミリーの間で保存されている領域を用いてPCRクローニングを試みたものであり、下記の結果を得ている。 1.得られたcDNAクローンは、既にクローニングされた高親和性ナトリウム依存性グルタミン酸トランスポーター、EAAC1、GLAST、GLT-1と39〜43%、中性アミノ酸トランスポーターASCT1と56%のアミノ酸配列の一致を認め、最近マウス精巣cDNAライブラリーからクローニングされたASCT2とは80%のアミノ酸配列の一致を認めた。ハイドロパシープロットもグルタミン酸トランスポーター遺伝子のファミリーと類似性が高く、このファミリーに属する新しい遺伝子のクローニングに成功したと考えられる。 2.このクローンの機能としてツメガエル卵の系を用いてナトリウム依存性の低親和性のL-アラニンの取り込みを認めた。この取り込みはN-メチルアラニンや 3.ラットの各組織からノーザンブロッティング解析を行ったところ、肺、大腸、骨格筋に強い発現を認め、腎、心、小腸、目、脳、肝といった多くの組織に発現を認めたが、精巣では発現を認めなかった。 4.従ってこのクローンはマウス精巣由来ナトリウム依存性高親和性中性アミノ酸トランスポーターASCT2と類似性は高いが、アミノ酸配列と輸送基質に対する親和性、並びに組織分布の違いからASCT2Bと名付けた。 以上、本論文はラット腎皮質表層からグルタミン酸トランスポーター遺伝子間で保存されている領域を用いてPCRクローニングを試み、ナトリウム依存性中性アミノ酸輸送機構システムASCに属する新しいナトリウム依存性低親和性中性アミノ酸トランスポーターASCT2Bの遺伝子をクローニングすることに成功した。本研究はこれまで未知であった腎臓における中性アミノ酸トランスポーターの機能の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/53914 |
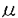 Mであった。二つの微小電極を用いた電位固定法ではL-アラニンによる電流は観察されなかった。[14C]L-アラニンの取り込みはN-メチルアラニンや
Mであった。二つの微小電極を用いた電位固定法ではL-アラニンによる電流は観察されなかった。[14C]L-アラニンの取り込みはN-メチルアラニンや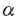 メチルアミノイソブチル酸(
メチルアミノイソブチル酸(