| 研究背景 1981年以降、コリン作動性神経細胞の表面マーカーを同定するためにWhittaker等がシビレエイ発電器官の膜画分を免疫して数種類のポリクローナル抗体を作製した。その内の1つであるanti-Chol-1は中枢および末梢神経系においてコリン作動性神経の細胞体および終末部の膜表面を特異的に染色する抗体として報告され、その後の研究によりその抗原Chol-1はガングリオシドであることが明かとなった。ガングリオシドはシアル酸を含むスフィンゴ糖脂質であり、特に神経系の細胞膜上に多く発現していることが知られている。神経系においてガングリオシドは神経突起伸長作用、受容体などの機能性タンパク質のリン酸化、シナプスの可塑性の促進などに関与しているとされているが、実際のところ生体における生理機能については未だに不明であった。Chol-1ガングリオシドは神経系において(1)魚類からヒトまで保存されている、(2)特定の細胞集団に発現している、(3)シナプス形成期から発現している、ことからガングリオシドの神経系における生理機能を探る上でChol-1ガングリオシドは非常に興味深い分子であると考えられていた。しかしながら微量成分であるが故に、その化学構造の決定は難しく、次の2分子が同定されていたに過ぎない。 IV3NeuAc,III6NeuAc,II3NeuAcGgOse4Cer (GT1a ) ) IV3NeuAc,III6NeuAc,II3NeuAc2GgOse4Cer (GQ1b ) ) 構造 そこでウシ脳よりChol-1ガングリオシドの精製を行なったところ、3種類のガングリオシドを単離することに成功した。それらの構造をFABマススペクトロメトリー、シアリダーゼ分解、TLC-免疫染色などにより解析した結果、すべて新規なガングリオシドであったのでGM1 、GD1a 、GD1a 、GT1b 、GT1b と命名した。 と命名した。 III6NeuAcGgOse4Cer (GM1 ) ) III6NeuAc,II3NeuAcGgOse4Cer (GD1a ) ) III6NeuAc,II3NeuAc-NeuGcGgOse4Cer (GT1b ) ) いずれも微量な成分であり、10gのウシ脳ガングリオシド画分からそれぞれ150、20、10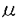 gという収量であった。その結果これまで同定された5つのChol-1ガングリオシドは共通してNeuAc gという収量であった。その結果これまで同定された5つのChol-1ガングリオシドは共通してNeuAc 2-6GalNAc構造を持つことが明かとなった。 2-6GalNAc構造を持つことが明かとなった。 生合成 この共通構造と生合成との関係を調べるために、GalNAc 2-6シアル酸転移酵素の活性をラット肝臓ゴルジ画分を用いて測定した。すでに肝臓の脂質抽出によりChol-1ガングリオシドの存在を確認しており、酵素タンパク質として調製容易なラット肝臓ゴルジ画分を使用した。酵素活性を調べた結果、5種類のChol-1ガングリオシドは全て最後にGalNAcヘシアル酸を転移することにより合成されることが判明した。NeuAc 2-6シアル酸転移酵素の活性をラット肝臓ゴルジ画分を用いて測定した。すでに肝臓の脂質抽出によりChol-1ガングリオシドの存在を確認しており、酵素タンパク質として調製容易なラット肝臓ゴルジ画分を使用した。酵素活性を調べた結果、5種類のChol-1ガングリオシドは全て最後にGalNAcヘシアル酸を転移することにより合成されることが判明した。NeuAc 2-6GalNAc構造が作られた後は新たなる糖転移反応が起こらないことも明らかになって、Chol-1ガングリオシドはガングリオシド代謝における最終産物であることが示唆された。また同じNeuAc 2-6GalNAc構造が作られた後は新たなる糖転移反応が起こらないことも明らかになって、Chol-1ガングリオシドはガングリオシド代謝における最終産物であることが示唆された。また同じNeuAc 2-6GalNAc構造持つ別のガングリオシドGD1 2-6GalNAc構造持つ別のガングリオシドGD1 を合成する を合成する 2-6シアル酸転移酵素ではChol-1ガングリオシドは生合成されないことから、神経系において複数の 2-6シアル酸転移酵素ではChol-1ガングリオシドは生合成されないことから、神経系において複数の 2-6シアル酸転移酵素が存在することが示された。 2-6シアル酸転移酵素が存在することが示された。 分布 ポリクローナル抗体anti-Chol-1を用いた免疫組織染色の結果から、Chol-1ガングリオシドはコリン作動性神経の細胞体および終末部の膜表面に発現していることが既に報告されている。個々のChol-1ガングリオシドの発現分布を明らかにするために2種類のChol-1分子(GT1a とGQ1b とGQ1b )を認識するモノクローナル抗体(GGR-41)を作製した。GGR-41を用いてラット脳切片の免疫組織染色を行なった結果、主に脊髄(後角)、延髄(孤束核)、中脳(中心灰白質、上丘、脚間核)前脳(中隔野外側亜核)に抗原の発現が確認された。これらの部位はいずれもコリン作動性神経の終末部の存在する場所であることが報告されており、GT1a )を認識するモノクローナル抗体(GGR-41)を作製した。GGR-41を用いてラット脳切片の免疫組織染色を行なった結果、主に脊髄(後角)、延髄(孤束核)、中脳(中心灰白質、上丘、脚間核)前脳(中隔野外側亜核)に抗原の発現が確認された。これらの部位はいずれもコリン作動性神経の終末部の存在する場所であることが報告されており、GT1a とGQ1b とGQ1b は終末部にのみ発現していることが明かとなった。分化させたコリン作動性神経芽細胞(NG108-15)をGGR-41により染色した結果からも、終末部にのみ抗原の発現が確認された。以上の知見からGT1a は終末部にのみ発現していることが明かとなった。分化させたコリン作動性神経芽細胞(NG108-15)をGGR-41により染色した結果からも、終末部にのみ抗原の発現が確認された。以上の知見からGT1a とGQ1b とGQ1b は軸索の終末部に存在し、他のChol-1ガングリオシドは細胞体に存在する可能性が示唆された。 は軸索の終末部に存在し、他のChol-1ガングリオシドは細胞体に存在する可能性が示唆された。 機能 神経系におけるChol-1ガングリオシドの機能の1つとして、GQ1b が百日咳毒素によるADP-リボシル化およびNAD+水解反応に対して阻害的に働くことを見い出した。ウシ脳膜画分中においてこの阻害活性の存在が報告されていたが、物質的裏付けはなされていなかった。この阻害活性はタンパク質画分には存在せずガングリオシド画分に検出されたことから、精製ガングリオシド標品のADP-リボシル化反応に対する効果を検討したところ、GQ1b が百日咳毒素によるADP-リボシル化およびNAD+水解反応に対して阻害的に働くことを見い出した。ウシ脳膜画分中においてこの阻害活性の存在が報告されていたが、物質的裏付けはなされていなかった。この阻害活性はタンパク質画分には存在せずガングリオシド画分に検出されたことから、精製ガングリオシド標品のADP-リボシル化反応に対する効果を検討したところ、GQ1b による特異的な反応であり、構造類似体であるGT1a による特異的な反応であり、構造類似体であるGT1a では阻害が起こらないことが判明した。また基質であるNAD+に対して競合的な阻害反応であることから、この阻害機構はNAD+の持つ2つのリン酸基をGQ1b では阻害が起こらないことが判明した。また基質であるNAD+に対して競合的な阻害反応であることから、この阻害機構はNAD+の持つ2つのリン酸基をGQ1b 内の2つのシアル酸分子が負の電荷を介して疑似することによるものと考えられた。実際空間充填モデルを作製したところ、2つのシアル酸分子内のカルボキシル基間の距離を熱力学的に安定な状態でNAD+のリン酸基間の距離に近付けることが可能であることが明かとなった。 内の2つのシアル酸分子が負の電荷を介して疑似することによるものと考えられた。実際空間充填モデルを作製したところ、2つのシアル酸分子内のカルボキシル基間の距離を熱力学的に安定な状態でNAD+のリン酸基間の距離に近付けることが可能であることが明かとなった。 考察 ガングリオシドの精製法および抗体を用いた高感度検出法の技術向上に伴い、微量な成分の化学構造が次々と明かとなっている。anti-Chol-1によって認識される5種類のChol-1ガングリオシドは全てNeuAc 2-6GalNAc構造を持つことから、抗体の認識部位はこの共通構造であると考えられた。シアル酸転移酵素によるNeuAc 2-6GalNAc構造を持つことから、抗体の認識部位はこの共通構造であると考えられた。シアル酸転移酵素によるNeuAc 2-6GalNAc構造合成後、糖鎖の転移反応が停止することから、この共通構造はガングリオシド合成において最終産物を決定するという重要な役割を担っていることが示唆された。anti-Chol-1とGGR-41を用いた免疫組織染色の結果の違いから、細胞体または終末部と発現部位が異なることが考えられ、この結果はゴルジ体で合成されたガングリオシドの糖鎖構造の違いによる選択的な細胞膜への輸送機構の存在を反映するものと思われた。 2-6GalNAc構造合成後、糖鎖の転移反応が停止することから、この共通構造はガングリオシド合成において最終産物を決定するという重要な役割を担っていることが示唆された。anti-Chol-1とGGR-41を用いた免疫組織染色の結果の違いから、細胞体または終末部と発現部位が異なることが考えられ、この結果はゴルジ体で合成されたガングリオシドの糖鎖構造の違いによる選択的な細胞膜への輸送機構の存在を反映するものと思われた。 スフィンゴ脂質およびコレステロールは水素結合を介して細胞膜表面において膜タンパク質(特にGPI-アンカータンパク質)と複合体"microdomain"を形成し、脂質がタンパク質の機能を調節していると考えられている。例えばNGFの神経突起伸長作用を促進するGM1aガングリオシドが高親和性NGF受容体と結合性して受容体のチロシンリン酸化を促進することが明らかとなっている。分化させたコリン作動性の神経芽細胞(NG108-15)をGGR-41を用いて染色すると終末部にのみ観察される染色像は膜全体に均一に見られるのではなく、点状にドメインを形成して観察されたことから、Chol-1ガングリオシドも膜上でタンパク質と"microdomain"を形成している可能性が十分考えられた。 今回得られた知見から1つの可能性として、GQ1b はコリン作動性神経終末部においてNAD+代謝活性を有するタンパク質と複合体を形成していると考えられた。細胞膜表面において複合体を形成している相手のタンパク質の候補として、ヒトリンパ球細胞表面マーカーとして知られているCD38抗原が考えられた。CD38は脳においてもその発現が確認されており、ectoenzymeとしてNAD+水解酵素および環状ADP-リボース合成酵素活性を持ち、既に両酵素活性に対してもGQ1b はコリン作動性神経終末部においてNAD+代謝活性を有するタンパク質と複合体を形成していると考えられた。細胞膜表面において複合体を形成している相手のタンパク質の候補として、ヒトリンパ球細胞表面マーカーとして知られているCD38抗原が考えられた。CD38は脳においてもその発現が確認されており、ectoenzymeとしてNAD+水解酵素および環状ADP-リボース合成酵素活性を持ち、既に両酵素活性に対してもGQ1b が抑制的に働くことが判明した。CD38はB細胞を活性化する際に、チロシンリン酸化酵素を活性化する可能性が明かとなっている。またGPI-アンカータンパク質はB細胞において非受容体型チロシンリン酸化酵素と複合体を形成することから、GQ1b が抑制的に働くことが判明した。CD38はB細胞を活性化する際に、チロシンリン酸化酵素を活性化する可能性が明かとなっている。またGPI-アンカータンパク質はB細胞において非受容体型チロシンリン酸化酵素と複合体を形成することから、GQ1b とCD38の特異的な相互作用はGPI-アンカータンパク質とチロシンリン酸化酵素との複合体の形成に関与しており、上記のGM1aガングリオシドの例に見られる様に、タンパク質のリン酸化を調節している可能性が考えられた。 とCD38の特異的な相互作用はGPI-アンカータンパク質とチロシンリン酸化酵素との複合体の形成に関与しており、上記のGM1aガングリオシドの例に見られる様に、タンパク質のリン酸化を調節している可能性が考えられた。 細胞膜の構成成分としての役割だけではなく、タンパク質の機能調節にガングリオシドが関与している知見はガングリオシドの生理機能解明に大きく貢献するものと思われる。 |