[序論]真核細胞の細胞周期のG1期は外部環境の変化に応じて増殖の進行或いは停止、もしくは分化への移行を決定する役割を担っている。酵母のG1期には"START"と呼ばれるポイントがあり、細胞は"START"を越えて一度S期へ進行するとそのサイクルが終了するまで分化過程に移行することはできない。出芽酵母の"START"では、G1/S期に特異的な遺伝子発現を調節することにより細胞周期の開始を行っている。この時発現誘導される遺伝子群のプロモーター領域にはSCB(Swi4/6 cell cycle box)或いはMCB(MluI cell cycle box)と呼ばれるエンハンサーが存在し、Swi4(Mbp1)-Swi6転写複合体が結合する(図1)。このSwi4、Mbp1、Swi6蛋白質はいずれも中心部に2個のアンキリンモチーフを持ち、Swi4(Mbp1)-Swi6複合体はそれ自体で完全な転写活性化能を持つものと考えられていた。一方、分裂酵母では、Swi6とよく似たCdc10が細胞周期開始因子として以前から知られてる。最近我々の研究室で2種類のSwi4様因子であるRes1、Res2が発見された。解析の結果、分裂酵母では、Res1-Cdc10、Res2-Cdc10の2組の転写複合体が並列して働き、前者は主に体細胞分裂、後者は主に減数分裂の開始において働いていることが明らかになった(図1)。 更に最近、我々の研究室でcdc10変異株のマルチコピーサプレッサーとしてrep1+が単離された。rep1+はC末付近に1つのzinc finger構造を有する蛋白質をコードしており、rep1破壊株は減数分裂を開始できない。解析の結果、Rep1は減数分裂でのres2+の発現に必要であることが明らかとなり、更に、Res2-Cdc10の活性化因子である可能性も示唆された(図1)。 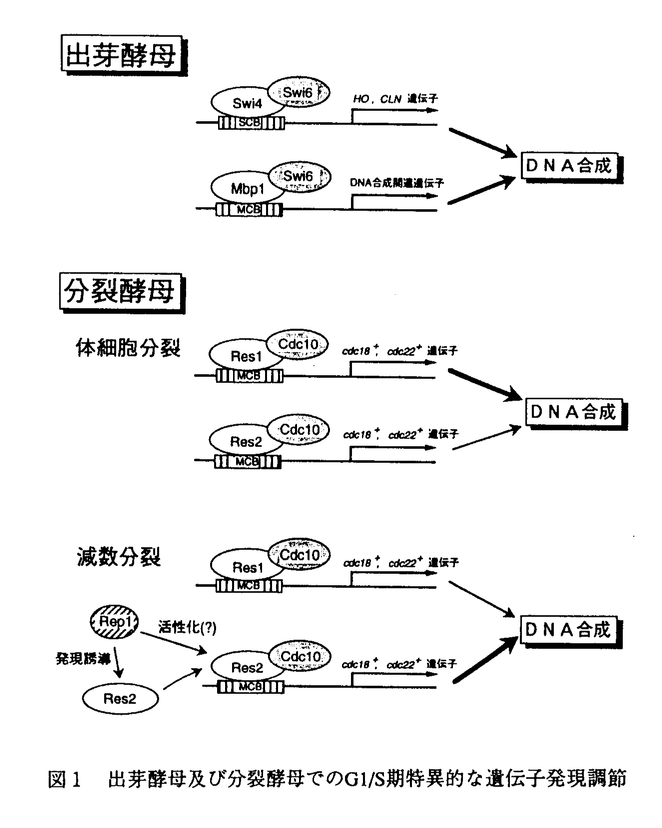 図1 出芽酵母及び分裂酵母でのG1/S期特異的な遺伝子発現調節 図1 出芽酵母及び分裂酵母でのG1/S期特異的な遺伝子発現調節 rep1破壊株は、栄養増殖中から減数分裂へ誘導した場合、減数分裂を開始することができる。また、rep1+の過剰発現は、cdc10変異株及びres1破壊株の体細胞分裂での変異を抑圧することができる。これらは、体細胞分裂で機能するRep1様因子の存在を示唆している。本論文では体細胞分裂でのRep1様因子であるRep2を単離し、Rep2がRes2-Cdc10転写複合体の活性化サブユニットであること、外界の栄養源シグナルを受けて増殖の進行と停止を調節する因子であることを明らかにした。 [結論]cdc10温度感受性変異株のマルチコピーサプレッサーとしてrep2+を単離した。rep2+は、cdc10変異のみならずres1破壊株の変異をも抑圧できた。塩基配列決定の結果、rep2+は、rep1+遺伝子産物と同様、C末付近に一つのzinc finger構造を有する蛋白質をコードしていることが明らかとなった。 遺伝子破壊株を作製したところ、破壊株は低温感受性を示し、18℃以下で増殖できなかった。この時細胞は長く伸びて典型的なcdc表現型を示し、"START"以前のG1期で停止していた。更に減数分裂の開始にも弱い欠損を示し、rep1 rep2二重破壊株は、増殖中から減数分裂へ誘導した場合でも減数分裂を開始することができなかった。 rep2破壊株の低温感受性はrep1+、res1+の過剰発現により強く、cdc10+により弱く抑圧された。しかし、res2+の過剰発現は低温感受性を抑圧せず、逆に増殖を阻害した。このことは、Rep2が存在しなければRes2-Cdc10は活性を失い、この転写活性のない複合体がターゲットであるMCBに結合し、Res1-Cdc10の活性を競合阻害する(図2)と考えることにより解決できる。実際、Res2-Cdc10がそれ自体でMCBに結合することがすでに示されている。この仮説はrep2 res2二重破壊株で低温感受性が回復したことから正しいことが示唆された。尚、rep2 res2二重破壊株はres2破壊株とほぼ同じ表現型を示したため、Rep2の主なターゲットはRes2であると考えられる。次に、Rep2とRes2の結合をTwo-hybrid法を用いて調べたところ、その相互作用が確認され、更に、Rep2はそれ自身で転写活性化能を有することが示唆された。また、Res2蛋白質は、大腸菌で作らせたGST-Rep2と結合できること、分裂酵母細胞粗抽出液を用いた免疫沈降実験でRep2はRes2-Cdc10と共沈することから、Rep2はRes2-Cdc10複合体と結合することが示された。以上の結果より、Rep2はRes2-Cdc10転写複合体の転写活性化サブユニットであると考えられる(図2)。 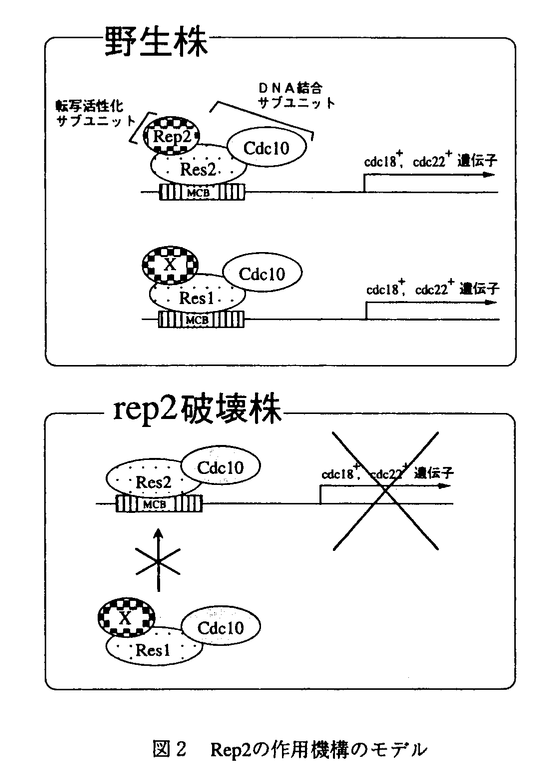 図2 Rep2の作用機構のモデル 図2 Rep2の作用機構のモデル 次に、増殖の進行と停止におけるRep2の役割について調べた。rep2+の発現は、窒素源枯渇によるG1期停止に伴い減少し、添加による増殖の開始で増加した。また、rep2破壊株は窒素源枯渇によりG1期停止しやすく、逆に、過剰発現株ではG1期停止が著しく阻害された。以上のことから、rep2+は窒素源のシグナルを受けて細胞周期の開始と停止に関わる新しい制御因子であることが明らかとなった。 [考察]分裂酵母では、Res1-Cdc10、Res2-Cdc10の2組の転写複合体が並列して働き、G1/S期に特異的な遺伝子発現を調節することにより細胞周期の開始を行っている。本論文では、新しい細胞周期の開始因子であるRep2を単離、解析したことにより、Res2-Cdc10の転写活性化機能にはRep2が転写活性化サブユニットとして必要であることを示した。rep2+は、栄養源によってその発現が調節され、rep2破壊株ではG1期に停止しやすく、逆に過剰発現株ではG1期停止が阻害されることから、rep2+の発現により細胞周期の開始が制御されていることが示唆された。しかし、通常の細胞周期ではrep2+の発現に変動は見られないが、転写活性はG1/S期のみに見られることから、rep2+の発現による制御以外に、Rep2とRes2-Cdc10の結合能の変化、蛋白質量の変化、修飾の変化、あるいは他の因子の関与等の制御も考えられる。 減数分裂の開始ではRep1が働いており、res2+の発現誘導に必要である。しかし、res1破壊株の体細胞分裂での変異をrep1+の過剰発現により抑圧する場合は、res2+の発現量の増加は見られないため、Res2-Cdc10の活性化因子としても働いている可能性が以前に示されてた。本論文で示したRep1とRep2の構造上と機能上の類似性から、Rep1は減数分裂においてRes2-Cdc10の転写活性化サブユニットとして働いていると推測される。またRes1-Cdc10複合体も同様に、未知のRep2様蛋白質によりその活性が制御されているものと予想される。更に、出芽酵母をはじめとする他の真核生物においても、Rep2様蛋白質が関与する類似の"START"制御機構の存在が予想される。 本論文においてRep2を発見したことにより、これまで単独で活性を有すると考えられていたCdc10/Swi転写因子ファミリーの概念を覆し、外界のシグナルを受けて転写活性を調節するサブユニットの存在が明らかになった。この発見は、今後のより詳細な"START"制御機構の解明に向けて重要な手がかりになると思われる。 |