血管新生は通常、(1)細胞間基質蛋白質の分解、(2)内皮細胞の遊走、(3)内皮細胞の増殖、(4)内皮細胞の分化と管腔形成の過程を含んでいる。個体レベルで考えると、例えば胎生期における脈管系の形成や各種臓器の構築への関与、成熟雌の一連の性周期過程における黄体形成、子宮内膜の一過性増殖等、挙げられる。一方、病的血管新生は関節リュウマチ、乾癬、糖尿病性の網膜症や固形腫瘍に於ける腫瘍血管等、多くの疾病に認められる。これらの生理的及び病的血管新生でその中心的役割を演じると考えられる内皮細胞について、その増殖制御機構の解明は重要な課題である。近年、VEGF/VPFと呼ばれる蛋白質因子とその受容体であるFLTファミリー(flt-1、KDR/flk-1、flt-4)が内皮細胞の増殖分化に密接に関与することを示唆する報告が相次いでいる。 VEGF/VPF(vascular endothelial growth factor/vascular permeability factor)は分子量約45kDaの液性蛋白質因子であり、血管透過性亢進物質又は内皮細胞増殖因子として単離された。ヒトVEGFはmRNAスプライシングの相違により4つのサブタイプ(VEGF121、VEGF165、VEGF189及びVEGF206)が存在し、何れも二量体の糖蛋白質として機能する。またVEGFに近縁の遺伝子として、PlGF(placenta growth factor)が単離されたが、この遺伝子も2つのサブタイプ(PlGF-1とPlGF-2)を有していた。 VEGF受容体であるflt-1(fms-like tyosine kinase)遺伝子は、ヒト胎盤cDNA Libraryからfms(CSF-1)/kit(SCF)/PDGF受容体ファミリーに構造的類似性を示す新しい受容体チロシンキナーゼ遺伝子として単離された。flt-1遺伝子産物は1338アミノ酸をコードする受容体型蛋白質で、リガンド結合領域である細胞外ドメインはシステイン残基が一定間隔をおいて存在し、7個のIgドメインを形成するイムノグロプリン・スーパーファミリーに属する遺伝子であった。FLT-1受容体関連遺伝子としてはヒトKDR(kinase insert domain-containing receptor)遺伝子、マウスに於けるKDRホモローグflk-1(fetal liver kinase-1)遺伝子及び、flt-4遺伝子が単離されており、これらFLTファミリー遺伝子は血管内皮細胞系に強く発現し、機能することが報告されつつある。 FLTファミリーの内皮細胞に於ける生物学的機能は、まず第一にリガンドであるVEGF/PlGFと各受容体の細胞外ドメインとの結合反応により惹起・維持されると考えられる。その結合の分子機構は未だ不明であり、受容体から下流の情報伝達経路も充分明らかではない。それ故、受容体のリガンド結合領域を同定することはFLTファミリーの活性化の制御機構を研究する上で非常に重要と考えられた。今回、筆者はFLT-1受容体の細胞外領域について種々の欠失変異蛋白を作成し、その構造的、機能的特質の解析を試みた。 ヒトflt-1遺伝子のアミノ酸翻訳領域の全てを持つpUC118クローン(flt3-7)より細胞外ドメインについて各欠失変異遺伝子を構築した(図表参照)。 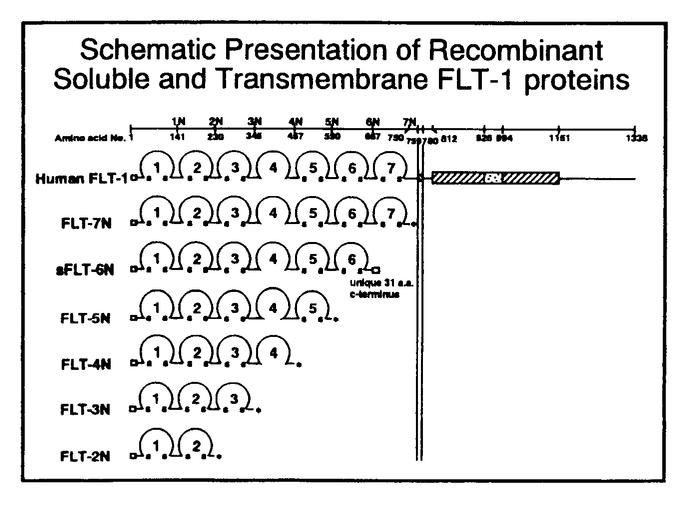 図表 図表 FLT-1の細胞外領域について遊離型の各欠失蛋白を組換えバキュロウイルスを用いた昆虫細胞による蛋白質発現システムを用いて作成、ヘパリン・カラムを用いてアフィニティー精製を試みた。各精製蛋白質を同定するとFLT〜2Nは約26kDa、3Nは約42kDa、4Nは約50kDa、6Nは約85kDa、7Nは約93kDaの糖鎖の付加したやや拡散したバンドが認められた。 各精製蛋白質を用いて細胞外ドメインとVEGF及び、PlGFの親和性を固相上の結合実験により検討した。96ウエル・プレート上に精製した各FLT-1細胞外ドメイン蛋白質を付着させ、非特異的吸着をBSAによりブロッキング後、Binding buffer(DMEM/25mMHEPES-NaOH[pH7.6]/0.3%BSA)で希釈した125I-VEGF又は125-PlGFを分注、室温で3時間反応させた。反応終了後Binding bufferで3回洗浄し、 線カウンターで各ウエルの放射線量を測定、結合した125I標識リガンドについて検討した。その結果、125I-VEGF及び、125I-PlGFはFLT-3Nを含め、それ以上のドメイン構造を持つものと高親和性に結合した。FLT-2Nと各リガンドの結合は検出限界以下であった。また競合阻害の実験から125I-VEGFの結合は非標識VEGFにより量依存的に置換されており、FLT-1細胞外ドメインと特異的に結合したことが示された。各細胞外ドメイン蛋白のVEGFに対する親和性の比較のためScatchard解析を試みた。VEGFに対して高親和性結合能を持つ最小の構造は3Nであり、解離定数(Kd値)は6.5pMであった。又全での細胞外ドメインを持つ7NはKd値17.0pMを示したが、3Nから7Nの間で結合能力の相違は僅かであり、これらの値はヒト血管内皮細胞で報告されているVEGFの高親和性領域のKd値に一致した。一方、125I-PlGFについてはKd値は3Nが447pM、7Nが193pMでありドメインを多く持つもの程、PlGF-1と強く結合する傾向が認められた。 線カウンターで各ウエルの放射線量を測定、結合した125I標識リガンドについて検討した。その結果、125I-VEGF及び、125I-PlGFはFLT-3Nを含め、それ以上のドメイン構造を持つものと高親和性に結合した。FLT-2Nと各リガンドの結合は検出限界以下であった。また競合阻害の実験から125I-VEGFの結合は非標識VEGFにより量依存的に置換されており、FLT-1細胞外ドメインと特異的に結合したことが示された。各細胞外ドメイン蛋白のVEGFに対する親和性の比較のためScatchard解析を試みた。VEGFに対して高親和性結合能を持つ最小の構造は3Nであり、解離定数(Kd値)は6.5pMであった。又全での細胞外ドメインを持つ7NはKd値17.0pMを示したが、3Nから7Nの間で結合能力の相違は僅かであり、これらの値はヒト血管内皮細胞で報告されているVEGFの高親和性領域のKd値に一致した。一方、125I-PlGFについてはKd値は3Nが447pM、7Nが193pMでありドメインを多く持つもの程、PlGF-1と強く結合する傾向が認められた。 固相上に比して分子運動の自由な溶液中でFLT-1細胞外ドメインとVEGFの複合体形成を検討した。反応液(20mM HEPES-NaOH[pH7.6]/150mM NaCl/0.03%BSA)中で一定量の125I-VEGFに対して1/5、2、20倍量の各細胞外蛋白を加え4℃、2時間反応させた後、形成された複合体をbis(sulfosuccinimidyl)suberateにより非可逆的に架橋し、複合体の分子量を検討した。FLT-3Nから7Nの各細胞外蛋白は125I-VEGFとの複合体形成が明瞭に認められたのに対し、2Nも微量であるが複合体が検出出来た。複合体の構成分子は2N及び3Nにおいてはモノマー複合体(3N1分子+VEGF2分子)から成るが、4Nでは約92kDaのモノマー複合備4N1分子+VEGF2分子)に加え、約142kDaのダイマー複合体(4N2分子+VEGF2分子)が僅かながら形成された。5Nから7Nにおいてはモノマー及びダイマー複合体の存在が明瞭に認められた。また1000倍量のbFGF、VEGFと構造的に類似したPDGF及び、非標識VEGFをcompetitorとして競合試験を行なったが、bFGFやPDGFでは複合体形成を阻止出来ず、VEGF/FLT-1の特異的反応であることを確認した。 FLT-1細胞外ドメイン蛋白の生物活性を検討するため、ラット肝類洞壁内皮細胞培養系におけるVEGF活性の抑制効果について試験した。調製細胞をプレートに蒔いた後、一定量のVEGFに対して各FLT-1細胞外ドメイン蛋白を各々2、10、50倍量加えて培養した。培養終了後、細胞を染色、実体顕微鏡下で肝類洞壁内皮細胞を同定、細胞数を計算した。その結果、FLT-3Nから7Nを添加したプレートでは加えた細胞外蛋白量に依存して肝類洞壁内皮細胞の増殖が抑制され、50倍量加えることによりVEGF活性はほぼ完全に阻害された。一方、2Nを添加したものでは抑制効果はほとんど認められなかった。 以上のことから、FLT-1細胞外領域はアミノ末端側の3個のイムノグロブリン様ドメインがリガンドとの高親和性結合に関与し、VEGF及び、PlGFは同じ領域又は近傍に結合することが示唆された。4番目から7番目のドメインについては受容体ダイマー形成等、受容体間の相互作用に関係することが示唆された。また、FLT-3Nから7Nはリガンドに対して競合阻害物質として機能し、FLT受容体ファミリーの活性化制御を行う薬剤としての可能性が示された。 |