研究の背景と目的 大腸癌は最近30年間で死亡原因にしめる割合が急激に増加しており、その治療は社会的にも重要な課題である。大腸癌の確実な治療のためには転移の無い状態での早期発見と切除が必要であり、検診でも大腸内視鏡検査などが次第に広く行われるようになってきた。大腸癌の特徴の一つは、その発生母地として良性腫瘍である腺腫性病変が重要であると考えられていることであり(adenoma-carcinoma sequence)、検査時に発見された腺腫性病変の内視鏡的切除も積極的に行われている。
腺腫が大腸癌の発生母地となることについては、実際に腺腫性病変の中に癌が併存することがしばしば見られるなど、これを支持する根拠がいくつかあるが、近年の分子生物学的研究からもこれを示唆する知見が得られてきている。Vogelsteinらは、RFLP(restriction fragment length polymorphism)法などにより大腸腫瘍のgeneticな変化を検討し、小さな腺腫性ポリープにはKi-ras遺伝子の変異や第5染色体長腕(5q)の欠失が約半数で見られるのに対し、癌ではこれらの異常に加えて第17染色体短腕(17p)や第18染色体長腕(18q)の欠失が起こっていることを発見した。その後の研究で、大腸腺腫から大腸癌に至るgenetic eventのtargetとなるl7p、18q上の遺伝子としてp53、DCC遺伝子がそれぞれ同定されたが、腺腫の発生に関わると思われる5q上の遺伝子についても検索が進められ、1991年に、Nakamuraらのグループと、WhiteらのグループによってAPC(adenomatous polyposis coli)遺伝子が単離された。
APC蛋白の分子量は約300kDで、Western blotなどの結果から細胞質に存在すると考えられている。その正常細胞における機能を調べることは細胞の腫瘍化の機構を探る上で非常に有用であると考えられるが、その構造には既知の蛋白との類似性はあまり見られず、機能を示唆する手がかりも得られていない。現在のところ、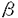 -cateninやplakoglobinと結合することが報告されており、細胞間接着や細胞骨格系に関与している可能性が有るが、それ以上の詳細は不明である。細胞内の分布についても、遺伝子のtransfectionによりAPC蛋白を過剰発現した細胞ではmicrotubulesに一致した分布が見られるという報告があるが、培養細胞で内因性のAPC蛋白を検出したという報告はない。しかし、大腸正常粘膜ではAPC蛋白が免疫染色で検出されているほか、Western blotでは大腸粘膜上皮以上のAPC蛋白の発現が多くの培養細胞において見られており、これらの細胞においても免疫蛍光染色により内因性のAPC蛋白が検出できるものと考えられる。
-cateninやplakoglobinと結合することが報告されており、細胞間接着や細胞骨格系に関与している可能性が有るが、それ以上の詳細は不明である。細胞内の分布についても、遺伝子のtransfectionによりAPC蛋白を過剰発現した細胞ではmicrotubulesに一致した分布が見られるという報告があるが、培養細胞で内因性のAPC蛋白を検出したという報告はない。しかし、大腸正常粘膜ではAPC蛋白が免疫染色で検出されているほか、Western blotでは大腸粘膜上皮以上のAPC蛋白の発現が多くの培養細胞において見られており、これらの細胞においても免疫蛍光染色により内因性のAPC蛋白が検出できるものと考えられる。
今回の研究で私は、外来性に高発現させたAPC蛋白とは異なる、より生理的な条件での内因性のAPC蛋白の細胞内分布を明らかにすることにより、その機能を考える手がかりが得られるのではないかと考えた。この目的のため、APC蛋白に対するウサギポリクローナル抗体を作製し、培養細胞内での内因性のAPC蛋白の局在を検討した。
結果および考察 外科手術標本より採取したヒト正常大腸粘膜からRNAを抽出し、これを用いてRT-PCR法にてAPC遺伝子のcDNAの一部をクローニングした。このようにして得られたcDNA断片をGST融合蛋白発現ベクターに導入し、APC蛋白のN末端2箇所およびC末端1箇所の互いに重ならない部分をGST融合蛋白として精製した。これらのGST融合蛋白を抗原としてウサギを免疫して得られた血清を、抗原を固相化したアフィニティー精製カラムに通し精製抗体を得た。抗体名は、APC蛋白N末端の2箇所に対する抗体をPAb8、PAbl0、C末端の1箇所に対する抗体をPAb4とした。
まず、これらの抗体を用いて培養細胞のWestern blotを行ったところ、ヒト骨肉腫細胞HOS、ヒト肺腺癌細胞A549では正常APC蛋白に相当する約300kDの蛋白がいずれの抗体でも検出された。また、変異APC遺伝子のみを持っていることが知られているヒト大腸癌細胞SW480ではN末端側に対する抗体であるPAb8、PAb10により変異APC蛋白に相当する約150kDの蛋白が検出されたが、C末端側に対する抗体PAb4には反応する蛋白はなかった。さらに、HOS細胞からの免疫沈降物のWestern blotによる解析でも各抗体によって免疫沈降される約300kDの蛋白はWestern blotで他の2つの抗体のいずれとも反応することが確認され、これらの抗体はいずれもAPC蛋白と反応するものと考えられた。
次に、細胞内のAPC蛋白の局在を調べる目的で、培養細胞での免疫蛍光染色を行った。HOSではPAb8、PAb10ともに多くの細胞で細胞質内にdiffuseに分布する顆粒状の染色と核近傍に強く染まるspotが観察され、他にも顆粒状の染色がnetwork状に配列した細胞が少数みられた。このようなAPCの染色と細胞内の既知の構造の関係を調べるため、vimentinおよびtubulinとの2重染色を行った。その結果、network状のAPC蛋白の染色はvimentinnetworkにほぼ一致して配列していることが明らかとなった。colcemidを加えてmicrotubulesを破壊したHOSの染色でもAPCの染色はvimentinに一致していた。さらにHOS細胞でのmicrotubulesとの2重染色では、抗APC抗体で染色される核近傍のspotからtubulin filamentが放散する細胞がみられ、このspotはcentrosomeに一致するものと考えられた。
A549細胞の免疫蛍光染色でも、PAb8、PAb10ともに細胞内のdiffuseな顆粒状染色と核近傍のspot状染色が観察されたが、この他にPAb10では隣接する細胞間で細胞膜に沿って断続的に染色が認められた。2重染色でみると、隣接する細胞間でcytokeratin networkが連絡している部位に一致してPAb10による染色がみられたことから、APC蛋白がdesmosomeなどの細胞間接着装置に関連して局在する可能性があると考えられた。細胞膜に沿った免疫染色の反応はPAb8抗体では観察されなかった。
さらに、免疫蛍光染色でAPC蛋白とvimentinがco-localizeすることが示唆されたことから、免疫沈降反応によりAPC蛋白とvimentinが共沈するかどうかを検索した。その結果、PAb8、PAb10では免疫沈降によりAPC蛋白とともにvimentinが沈降するのが確認されたが、PAb4ではAPC蛋白は沈降するもののvimentinは検出されなかった。逆に抗vimentin抗体V9で免疫沈降するとvimentinとともにAPC蛋白が沈降してくることが確認できた。この結果からAPC蛋白がvimentinと会合していることが示唆される。
以上の免疫沈降の結果が各抗体とvimentinもしくはAPC蛋白との交差反応でないことを確認するために免疫沈降の前にcell lysateをSDS存在下にboilしてdenatureし、免疫沈降の結果の変化をみた。その結果、denatureを加えても抗APC抗体によるAPC蛋白の免疫沈降、および抗vimentin抗体によるvimentinの免疫沈降は変化しないが、抗APC抗体によるvimentinの沈降は完全に阻止された。これは、蛋白のdenatureによりAPC蛋白とvimentinの会合が乖離したためと考えられ、共沈が抗APC抗体とvimentinの交差反応によるのではないことを示唆する。
最後に、大腸組織の免疫蛍光染色による検討を行った。正常大腸粘膜におけるAPC蛋白の免疫染色についてはすでにSmithらによって報告されている。PAb8抗体での染色の結果、大腸粘膜上皮細胞では以前の報告と同様に、腺管の下部では発現が少なく、上部に移行するにしたがって強い発現がみられた。また、個々の細胞についてみると、基底膜側および刷子縁側に増強した染色がみられた。
腫瘍組織でのAPC蛋白の発現を調べた結果では、癌組織11検体中、APC蛋白の発現があったのは4検体(36%)で、他の7検体(64%)ではAPC蛋白の発現は低下していた。また、腺腫性病変でも、12検体中、発現がみられたのは4検体(33%)のみであり、8検体(67%)で発現が低下していた。従来の報告によると大腸腫瘍のうちAPC遺伝子の変異が検出されるのは約6〜7割であるといわれており、今回みられたAPC蛋白の発現低下がAPC遺伝子の変異に関連しているかどうかが問題となるが、標本上の問題のため遺伝子変異については検索できなかった。また、APCを発現していた組織の個々の細胞でのAPC蛋白の分布をみると、癌組織4検体のうち、正常上皮と同じように基底膜側、刷子縁側の染色増強がみられたのは1検体のみで、他の3検体では細胞全体にほぼ均一な発現がみられた。腺腫でAPC蛋白を発現していた4検体では、3検体で基底膜側、刷子縁側に染色の増強がみられ、細胞内に均一な発現がみられたのは1検体であった。APC遺伝子の異常はその多くが既に腺腫の段階で起こっており、腺腫から癌への変化の間には新たなAPC遺伝子の変異はほとんど起こっていないはずである。このことからすると、今回観察された癌と腺腫での細胞内のAPC蛋白の分布の違いは、新たなAPC蛋白の異常が加わったためというよりも、癌細胞における極性の乱れによる可能性もある。いずれにせよ、腫瘍組織での発現の低下や細胞内局在の変化がAPC遺伝子の変異に関係しているかどうかについては、今後さらに検討が必要である。