細胞内蛋白質のチロシン残基のリン酸化は、細胞の活性化、増殖や分化、あるいは癌化に重要な役割を果たしているが、これは主としてチロシンキナーゼ(Protein Tyrosine Kinase;PTK)とチロシンフォスファターゼ(Protein Tyrosine Phosphatase;PTP)の可逆的な反応により保たれ、生理機能を調節していると考えられている。本研究は、Srcファミリーチロシンキナーゼ、Cskチロシンキナーゼ、チロシンフォスファターゼに注目しシグナル伝達機構の解析を行ったものであり、下記の結果を得ている。 1.T細胞の活性化反応の初期にFynのキナーゼ活性がどのように制御されて、抗原受容体から核への情報伝達にかかわるのかを明らかにするために、T細胞活性化に伴って誘導されるc-fos遺伝子やIL-2遺伝子の転写活性を指標にしてFynの効果を、ヒトT細胞株JurkatにおけるCATアッセイにより調べた。この結果Fynのキナーゼ活性の亢進はc-fos遺伝子の転写を促進し、また、この転写活性はc-fosプロモーター中のエンハンサー配列のCREやTREよりはむしろSREを介して行われていることが示された。一方、IL-2プロモーターはFynの高発現のみでは活性化されないが、Fynに加えてConAとTPAの刺激を行うことによって活性化されることを示した。 2.T細胞内でのCskの効果を確かめるために、1のCATアッセイの系にCskを加えて検討した。その結果、野生型Fynによるc-fosおよびIL-2プロモーター活性の上昇は、Cskによって抑制されることが示された。しかし、Cskによるリン酸化部位であるC末のチロシン残基をフェニルアラニンに置換したFynの活性はCskで抑制されなかった。これらのことからCskがT細胞抗原受容体からのシグナル伝達系でもFynのC末端のチロシンのリン酸化を介して、抑制的に機能していることが示唆された。 3.lprマウスのリンパ節から新規PTP遺伝子cDNAを単離し、全長の塩基配列を決定した。その結果このcDNAは、細胞外領域に8つのファイブロネクチンタイプIII様ドメインを持ち、細胞内に1つのPTPドメインを持つ、1238アミノ酸から成る受容体型PTP(RPTP)をコードすることがわかった。この構造が、HPTP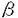 に類似していたことからこのPTPをByp(HPTPbeta like tyrosine phosphatase)と命名した。 に類似していたことからこのPTPをByp(HPTPbeta like tyrosine phosphatase)と命名した。 4.FISH法による染色体マッピングの結果から、マウスのbyp遺伝子は第2染色体のE1-2に、ラットでは第3染色体のq32-33にマップされた。この領域はマウス、ラットおよびヒトの間で保存された領域であり、ヒトでは第11染色体のp11-13に相当する。アミノ酸の相同性や染色体マッピングの結果より、BypはDEP-1(HPTP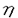 )のマウスホモローグと考えられた。 )のマウスホモローグと考えられた。 5.マウスの各組織、及び細胞株での、byp遺伝子の発現レベルを調べたところ、調べたすべての組織において約7.7kbのmRNAの発現が見られたが、特に脳、腎臓、脾臓で発現が高かった。マウス培養細胞株では骨髄球細胞株で発現が高かった。また、計算上のBypの分子量は134,000であるが、ウエスタンブロッティングや免疫沈降では200〜250kDaにバンドが認められた。tunicamycin処理により分子量が約130kDaに減少したことからByp蛋白質は高度にN型糖鎖結合修飾を受けており、その修飾は組織や細胞株により違いがあると思われた。 6.pNPPを基質としてin vitro PTPアッセイを行った結果、Byp蛋白質はPTP活性を保持していたが、PTPの活性中心と考えられているシステイン残基をセリン残基に置換した変異体(BypCS)ではPTP活性が失われた。 7.COS7細胞にFyn、Src、LynまたはYesをBypまたはBypCSを共発現させ、抗Byp抗体による免疫共沈を行った結果、Bypのチロシンリン酸化は、調べたSrcファミリーチロシンキナーゼ全てによって亢進することが示され、また同時に導入したSrcファミリーはチロシンリン酸化蛋白質としてBypCSと免疫共沈することが示された。 以上、本論文は、T細胞においてCskがin vivoにおいてもSrcファミリーチロシンキナーゼの活性をネガティブに調節することをc-fos,IL-2遺伝子の活性化を指標に明らかにし、また、Fynが過剰に発現しているlprマウスのリンパ節から新規のチロシンフォスファターゼ遺伝子をクローニングし、細胞・組織での発現、染色体上の局在、遺伝子産物の生化学的解析を行い、Srcファミリーチロシンキナーゼとの物理的会合を示した。本研究は、Srcファミリーチロシンキナーゼを介するシグナル伝達機構を解明する上で、重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |