| 緒言 糸球体が種々の原因で障害されると、メサンギウム細胞が活性化し、細胞増殖および細胞外基質やサイトカンの産生の増加をひき起こす。活性化したメサンギウム細胞は形質変換し、本来発現しない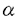 -smooth muscle actin( -smooth muscle actin(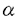 -SM actin)や間質型コラーゲンを発現することが報告されている。これらの形質変換は糸球体硬化の進展に深く関与しており、糸球体障害の発症および進展におけるメサンギウム細胞の形質変換の意義が注目されている。 -SM actin)や間質型コラーゲンを発現することが報告されている。これらの形質変換は糸球体硬化の進展に深く関与しており、糸球体障害の発症および進展におけるメサンギウム細胞の形質変換の意義が注目されている。 永井らは血管平滑筋ミオシン重鎖アイソフォームのcDNAクローニングに成功し、骨格筋や心筋同様、血管平滑筋においてもミオシン重鎖の多様性が存在することを示した。さらに3種類のアイソフォームの特異抗体を用いた免疫組織学的検討より、その発現は個体の成長過程や病的過程において著しく変化することを示した。そのひとつである非筋型ミオシン(SMemb)は胎児一新生児期の血管平滑筋で強く発現し、成長とともに漸減し成体では消失することから、幼若な平滑筋に特有のアイソフォームであると考えられた。しかし最近では、SMembが動脈硬化の発症過程における増殖平滑筋細胞に強く発現することや、培養平滑筋細胞、線維芽細胞、心筋細胞、肝細胞など、活性化した中胚葉系細胞に幅広く発現することが明らかになっている。 さらに、ヒトの生検腎標本において糸球体細胞におけるSMembの発現を検討したところ、病変の強い糸球体においてSMembの発現が著しく増加することや、それらが腎症の臨床経過とよく相関することが観察された。そこで今回我々は、ラットにて4種の糸球体障害モデル(抗Thy-1抗体腎炎、5/6腎摘、糖尿病性腎症、抗GBM抗体腎炎)を作成し、糸球体障害におけるメサンギウム細胞および糸球体上皮細胞の形質変換の意義を検討した。 方法 1)ラットモデル作成 ・抗Thy-1抗体腎炎:6週齢の雌Wistarラットを55匹用いた。抗Thy-1抗血清を静注し、1、3、5、8、21日後に11匹ずつ屠殺した。正常対照群として生理食塩水を静注したラットを、各時期に同数ずつ屠殺した。 ・5/6腎摘:6週齢の雄Wistarラットを55匹用いて右腎摘を施行し、2週間後に左2/3腎摘を施行した。3、10日後、および4、8、16週後に11匹ずつ屠殺を行った。正常対照群として開腹術のみを行ったものを、各時期に同数ずつ屠殺した。 ・糖尿病性腎症:6週齢の雄Wistarラットを44匹用いた。ストレプトゾトシンを静注し、3、10日後、および4、8週後に11匹ずつ屠殺を行った。正常対照群として生理食塩水を静注したラットを、各時期に同数ずつ屠殺した。 ・抗GBM抗体腎炎:6週齢の雄Sprague-Dawleyラットを11匹用い、抗GBM抗血清を静注し、7日後に屠殺した。正常対照群として生理食塩水を静注したラットを、同数屠殺した。 各群各時期に屠殺した11匹のうち、5匹を免疫組織染色、1匹を免疫電顕に用い、残り5匹の糸球体よりRNAを抽出し、RNaseプロテクションアッセイを行った。すべてのラットについて尿蛋白および血圧を測定し、糖尿病ラットには血糖の測定を追加した。 2)免疫組織染色:腎組織を95%エタノール+1%酢酸にて固定後、パラフィン包埋した。1 mの連続切片にてHE染色、PAS染色、および mの連続切片にてHE染色、PAS染色、および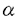 ・SM actin、SMemb、SM2、PCNAの特異抗体を用いた免疫組織染色を行った(LSAB法)。 ・SM actin、SMemb、SM2、PCNAの特異抗体を用いた免疫組織染色を行った(LSAB法)。 3)免疫電顕:腎組織をPLP液にて潅流固定後、SMembの糸球体細胞における発現を電子顕微鏡にて観察した(pre-embedding HRP法)。 4)RNaseプロテクションアッセイ:腎組織より糸球体を単離し、RNAを抽出した。ラット線維芽細胞よりRT-PCRにてcRNA probeを作成し、SMembのRNaseプロテクションアッセイを行った。 結果 正常糸球体において、SMembは糸球体上皮細胞にわずかに発現したが、メサンギウム細胞には発現を認めなかった。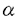 -SM actinは正常糸球体には全く発現しなかった。また、血管平滑筋細胞に特異的なミオシン重鎖アイソフォーム、SM2はいかなる場合にも糸球体細胞には発現しなかった。血圧は、すべてのモデルにおいて明らかな変化はみられなかった。 -SM actinは正常糸球体には全く発現しなかった。また、血管平滑筋細胞に特異的なミオシン重鎖アイソフォーム、SM2はいかなる場合にも糸球体細胞には発現しなかった。血圧は、すべてのモデルにおいて明らかな変化はみられなかった。 1)抗Thy-1抗体賢炎:抗Thy-1抗体腎炎では、尿蛋白は静注後1日目より増加し、3日をピークに以後減少した。正常対照群では尿蛋白の変化はみられなかった。光顕所見において、総糸球体細胞数は3日目で急性のメサンギウム細胞融解により減少したが、5日目で著明に増加し、8日目以降は再び減少した。免疫組織染色において、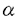 -SM actinは静注後1日目よりメサンギウム細胞に発現し、腎炎のピークの8日目ではさらに発現が増強した。 -SM actinは静注後1日目よりメサンギウム細胞に発現し、腎炎のピークの8日目ではさらに発現が増強した。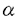 -SM actinの発現はPCNAの発現の経過と強く相関し、細胞数の正常化に伴って21日目には著明に減少した。SMembは -SM actinの発現はPCNAの発現の経過と強く相関し、細胞数の正常化に伴って21日目には著明に減少した。SMembは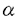 -SM actinより遅れて5日目より発現が増加し、8日目ではメサンギウム細胞に -SM actinより遅れて5日目より発現が増加し、8日目ではメサンギウム細胞に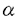 -SM actinと同程度の強い発現を認めた。しかし、SMembの発現は21日目以降も -SM actinと同程度の強い発現を認めた。しかし、SMembの発現は21日目以降も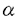 -SM actinと比較して強く残存していた。免疫電顕では、メサンギウム細胞、上皮細胞および内皮細胞にSMembの発現を認めた。さらに、RNaseプロテクションアッセイにより腎炎ラットの糸球体細胞におけるSMembの発現の増加を確認した。 -SM actinと比較して強く残存していた。免疫電顕では、メサンギウム細胞、上皮細胞および内皮細胞にSMembの発現を認めた。さらに、RNaseプロテクションアッセイにより腎炎ラットの糸球体細胞におけるSMembの発現の増加を確認した。 2)5/6賢摘:腎摘ラットにて、尿蛋白は4週目で著明に増加し、その後8週、16週でさらに増加した。光顕所見では、糸球体肥大および糸球体硬化を4週目より認め、16週まで徐々に進行した。免疫組織染色において、SMembは4週目ではメサンギウム細胞に発現を認めたが、8週から16週にかけては、むしろ上皮細胞に強く発現した。PCNA陽性細胞は10日目に一過性に増加した。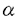 -SM actinは糸球体細胞には発現を認めなかった。また、免疫電顕においてSMembのメサンギウム細胞から上皮細胞への発現の移行が確認された。 -SM actinは糸球体細胞には発現を認めなかった。また、免疫電顕においてSMembのメサンギウム細胞から上皮細胞への発現の移行が確認された。 3)糖尿病性腎症:糖尿病ラットにおいて、尿蛋白は4週目で著明に増加し、8週でさらに増加した。血糖値は4週目より有意に上昇した。光顕所見では、細胞外基質の増加、糸球体肥大および糸球体硬化を4週目より認めた。免疫組織染色において、SMembは10日目ではメサンギウム細胞に発現したが、4週および8週ではSMembはむしろ上皮細胞に強く発現した。PCNA陽性細胞は3日目に軽度に増加した。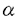 -SM actinの発現はいずれの時期にもみられなかった。免疫電顕において、SMembのメサンギウム細胞から上皮細胞への発現の移行が観察された。 -SM actinの発現はいずれの時期にもみられなかった。免疫電顕において、SMembのメサンギウム細胞から上皮細胞への発現の移行が観察された。 4)抗GBM抗体腎炎:腎炎ラットにおいて、尿蛋白は7日目に著明に増加した。光顕所見では基質増加、係蹄の癒着、半月体形成を認めた。免疫組織染色では、SMembは上皮細胞に強く発現したが、メサンギウム細胞には発現しなかった。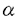 -SM actin、PCNAの発現の増加は認めなかった。免疫電顕において、上皮細胞におけるSMembの発現の増加が確認された。 -SM actin、PCNAの発現の増加は認めなかった。免疫電顕において、上皮細胞におけるSMembの発現の増加が確認された。 結論 本研究において、糸球体障害モデルにおけるSMembの発現を検討することにより、種々の障害による糸球体細胞の多様な形質変換が明らかになった。糸球体細胞における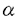 -SM actinの発現はメサンギウム細胞に限局していたが、SMembの発現はメサンギウム細胞のみならず上皮細胞においても著明に増加し、上皮細胞の形質変換が様々な病態で広汎にみられる現象であることが明らかになった。 -SM actinの発現はメサンギウム細胞に限局していたが、SMembの発現はメサンギウム細胞のみならず上皮細胞においても著明に増加し、上皮細胞の形質変換が様々な病態で広汎にみられる現象であることが明らかになった。 抗Thy-1抗体腎炎において、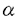 -SM actinとSMembはいずれもメサンギウム細胞にて強く発現したが、両者の発現様式は明らかに異なっており、 -SM actinとSMembはいずれもメサンギウム細胞にて強く発現したが、両者の発現様式は明らかに異なっており、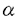 -SM actinはメサンギウム細胞増殖の時期に強く発現したのに対して、SMembの発現は増殖期の後半から増殖後に著明に増加した。また、SMembの発現は蛋白尿の経過とも一致せず、回復期にむしろ強い発現を認めた。これらの傾向は5/6腎摘と糖尿病性腎症でも認められ、SMembはメサンギウム細胞増殖の後に発現が増加した。以上より、 -SM actinはメサンギウム細胞増殖の時期に強く発現したのに対して、SMembの発現は増殖期の後半から増殖後に著明に増加した。また、SMembの発現は蛋白尿の経過とも一致せず、回復期にむしろ強い発現を認めた。これらの傾向は5/6腎摘と糖尿病性腎症でも認められ、SMembはメサンギウム細胞増殖の後に発現が増加した。以上より、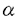 -SM actinは細胞増殖に、SMembは細胞増殖後の修復過程に、それぞれ関与している可能性が示された。 -SM actinは細胞増殖に、SMembは細胞増殖後の修復過程に、それぞれ関与している可能性が示された。 また、5/6腎摘と糖尿病性腎症において、疾患の時期によりSMembの発現の局在の変化がみられ、それらは免疫電顕においても確認された。SMembは導入初期はメサンギウム細胞に発現していたが、糸球体肥大の進行に伴い後半はむしろ上皮細胞において強く発現した。両モデルにおいて、後半の上皮細胞でのSMembの発現の増加は、糸球体肥大に伴う物理的な上皮細胞障害を反映していると考えられた。 本研究において、糸球体障害モデルにおけるSMembの発現の検討により糸球体細胞の多彩な形質変換が示された。SMembを用いることにより、糸球体疾患における従来の形態学的診断とは異なり、光顕レベルで簡便にメサンギウム細胞および上皮細胞の形質変換をみることが可能であり、腎症の経過とも相関することから、腎生検など臨床の場でもその応用が期待される。糸球体細胞の形質変換とその回復の機序の解明は、糸球体障害の発症と進展の機序の解明にもつながり、ひいては治療法の開発への道を開くものと期待される。 |