神経細胞は極性を持った形態をしており、刺激伝達の方向にそって樹状突起、細胞体、軸索という特徴的な形態を分化させている。細胞体とシナブスの間をつなぐ軸索は通常非常に長く、この中にはリボゾームがなく蛋白合成が行われないため、蛋白質、ミトコンドリア、シナプス小胞前駆体など軸索内で必要な物質はすべて細胞体で合成された後に末梢に運ばれている。これらの軸索内輸送は、その速度によって速い輸送と遅い輸送の2種類に分けられるが、速い輸送は膜小器官の運搬を司っており、その移送は微小管がレールとなりモーター蛋白が運搬される膜小器官との間に架橋構造を作ることによってなされている。このような軸索内輸送は神経細胞の形態形成、機能発現および機能維持にとり非常に重要な役割を担っており、その研究は、神経細胞にとどまらず全ての細胞内の物質輸送の機構を解明する上で、大変重要であると考えられる。 この軸索内輸送において重要な役割を果たすものとして、従来より微小管結合性モーター蛋白であるキネシンが知られていた。ところが、軸索内では様々の物質が色々な速度で運ばれており、膜小器官と微小管の間の架橋構造も様々な形をしていることから、キネシンのみで種々の物質の軸索内輸送の全てが説明されるとは考えにくい。一方、最近酵母などから細胞分裂の時に働くキネシンとホモロジーを持つ蛋白が幾つか見つかっており、神経細胞においても多種のキネシン及びその新しい関連蛋白が軸索内輸送を司っていることが予想された。 私は、キネシン関連蛋白間でホモロジーの高い部分をプライマーとしてPCRを行うことにより、マウス脳cDNAライブラリーから新しいキネシン関連蛋白を同定し、これをKIF(kinesin family)1Bと名付け、その全核酸配列を決定した。KIF1Bは、1150アミノ酸よりなる蛋白で、N末にモーター領域を持つキネシン関連蛋白であった。KIF1Bは、そのモーター領域において線虫のキネシン関連蛋白であるunc-104と特に高いホモロジーを示したが、それ以外の部分では他の蛋白との相同性は認められなかった。unc-104とホモロジーが高かったことは、KIF1Bの機能を推定する上で重要である。従来発見されたキネシン関連蛋白の殆どは細胞分裂に働いているのに対し、unc-104はその変異体による解析により細胞内小器官の輸送を司ることが示されている唯一のものである。unc-104とホモロジーが高かったことは、KIF1Bも細胞分裂ではなく細胞内小器官の輸送に関わることを示唆するものと考えられる。 KIF1Bは、アミノ酸配列からの2次構造予測によると、他のキネシン関連モーター蛋白一般とは異なり、そのrod domainと推定される部分において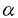 helix構造に乏しく、 helix構造に乏しく、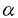 helical coiled-coilを作らない可能性が考えられた。このことは、KIF1Bのアミノ酸配列にLupasのcoiled-coil予測プログラムを適用することにより、より強く示唆された。キネシンはそのrod domainにおいす helical coiled-coilを作らない可能性が考えられた。このことは、KIF1Bのアミノ酸配列にLupasのcoiled-coil予測プログラムを適用することにより、より強く示唆された。キネシンはそのrod domainにおいす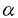 helical coiled-coil構造をとってダイマーを形成している。この構造がないということは、KIF1Bがダイマーではなくモノマーとして働く初めてのキネシン関連蛋白であることを示唆する。このことを確認するために私は、大腸菌により発現させたKIF1Bのtail部分に対するポリクローナル抗体を作成し、また昆虫細胞(Sf9-)を用いてKIF1Bを発現させ、その性質を調べた。まず、私はショ糖密度勾配遠心法及びゲルろ過法によりKIF1Bの沈降係数およびストークス半径を求め、そのnativeな状態での分子量を算出した。この値は、モノマーとしてのKIF1Bの値(130kd)とよく一致した。また、非還元条件下でnativePAGEを行い、その電気泳動度がモノマーとしてのKIF1Bのものと一致することを示した。最後に私は、精製したKIF1Bを用いて低角度回転蒸着法により、その単分子としての形態を電子顕微鏡で観察した。KIE1Bの精製は,微小管と結合したKIF1BをATP及びNaCl存在下で解離させ,それを更にショ糖密度勾配遠心法及びDEAEセルロースカラムを用いて精製することにより行なった。このようにして精製されたKIF1Bは、従来のキネシン関連蛋白がglobularな2個のhead domain、棒状のrod domain-、globular或いはfan-likeなtall domainという構造を持っていたのに対し、特異的な単一なglobularな構造を示した。このことにより、KIF1Bがモノマーであることが確認された。 helical coiled-coil構造をとってダイマーを形成している。この構造がないということは、KIF1Bがダイマーではなくモノマーとして働く初めてのキネシン関連蛋白であることを示唆する。このことを確認するために私は、大腸菌により発現させたKIF1Bのtail部分に対するポリクローナル抗体を作成し、また昆虫細胞(Sf9-)を用いてKIF1Bを発現させ、その性質を調べた。まず、私はショ糖密度勾配遠心法及びゲルろ過法によりKIF1Bの沈降係数およびストークス半径を求め、そのnativeな状態での分子量を算出した。この値は、モノマーとしてのKIF1Bの値(130kd)とよく一致した。また、非還元条件下でnativePAGEを行い、その電気泳動度がモノマーとしてのKIF1Bのものと一致することを示した。最後に私は、精製したKIF1Bを用いて低角度回転蒸着法により、その単分子としての形態を電子顕微鏡で観察した。KIE1Bの精製は,微小管と結合したKIF1BをATP及びNaCl存在下で解離させ,それを更にショ糖密度勾配遠心法及びDEAEセルロースカラムを用いて精製することにより行なった。このようにして精製されたKIF1Bは、従来のキネシン関連蛋白がglobularな2個のhead domain、棒状のrod domain-、globular或いはfan-likeなtall domainという構造を持っていたのに対し、特異的な単一なglobularな構造を示した。このことにより、KIF1Bがモノマーであることが確認された。 KIF1Bがモノマーであることは、非常に重要な意味を持っている。従来より、キネシンがダイマーを作っていることが、その機能上必須であるかどうかは議論の的であった。キネシンが微小管上を動くメカニズムについては、現在2つの説がある。1つはその2つのhead domainの協調した動きにより微小管上を"歩き"どちらか片方のhead domainが必ず微小管とコンタクトしているというもの、もう1つはキネシンのhead domainはそのATPase cycleのうち殆どの間微小管とコンタクトしており、微小管から離れている時間が非常に短いため微小管から拡散してはずれてしまうことなく動くというものである。KIF1Bはモノマーであることが確認され、しかも後述のようにin vitro motility assayによりモーター活性を持つことが示された、初めての蛋白である。KIF1Bを用いて単分子によるmotility assayを行うことができれば、この問題に関して更に詳しい知見が得られるものと考えられる。 次に、私は生体内でのKIF1Bの機能を知るために、ノーザンブロッテイングを行い、そのmRNAの臓器別の発現の違い、及び脳における時期別の発現の違いを調べた。KIF1BのmRNAは様々な臓器に発現がみられたものの特に心臓と脳に多く、発生時期による発現量の差は認められなかった。この結果は、前記抗体を用いたウエスタンブロッテイングにより確認された。 また、私は脳におけるKIF1Bの発現について更に細胞レベルでの詳しい解析を行うために、脳のin situ hybridizationを行った。この結果、KIF1BのmRNAは脳全体に発現がみられるものの特に海馬及び小脳皮質に多く、海馬錐体細胞、小脳顆粒細胞などの分化した神経細胞によく発現が認められることが分かった。 更に、私は免疫染色のためにKIF1Bの合成ペプチドに対する抗体を作成し、これを用いて培養細胞の免疫染色を行った。その結果、Neuro2A、PC 12、L cellにおいて細胞質にvesicle状及び管状の構造の染色がみられた。この構造はミトコンドリアを想記させるものであったため、私はミトコンドリア特異的色素との2重染色を行った。この結果、ペプチド抗体によって示されたKIF1Bの局在は、ミトコンドリア特異的色素(ミトトラッカー)の染色に一致することが判明した。一方、シナプス小胞に特異的なシナプトフィジンに対する抗体を用いて2重染色を行ったところ、両者の染まりは全く一致しなかった。また、このペプチド抗体の染色は、抗原に使用した合成ペプチドによりブロックされるが、他のキネシン関連蛋白の合成ペプチドではブロックされないことから、特異的なものであることが確認された。更に私は、ミトトラッカーが私の使用した細胞において実際にミトコンドリアを染色していることを確認するため、低濃度においてミトコンドリアを特異的に染色することが知られているDiOC6(3)との2重染色を行った。この結果、KIF1Bの局在が示された構造物はミトコンドリアであることが確認された。 免疫染色の結果を確認するため、我々はミトコンドリアをラット脳よりStahlの方法を用いて生化学的に精製し、その過程でのKIE1Bの量的変化をウエスタンプロッテイングにより調べた。この結果、KIF1Bはその精製過程と共にミトコンドリア分画に濃縮されることが示された。精製したミトコンドリア分画は、ミトコンドリア特異的な抗チトクロームオキシダーゼ抗体を用いたウエスタンブロッテイングにより十分濃縮されていること、及び電子顕微鏡による観察により非常に純度が高いことを確認した。また、コントロールに用いた他のキネシン関連蛋白では、このようなミトコンドリア分画への濃縮はみられなかった。一方、シナプス小胞を精製しその過程において同様にウエスタンブロッテイングを行ったところ、KIF1Bの濃縮は認められなかった。 最後に、私はVE-DIC顕微鏡を用いたin vitro motility assayによりKIF1Bのモーター蛋白としての機能を解析した。KIF1Bは微小管を0.66±0.17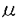 m/sの速度で動かした。この速度は、速い軸索内輸送の速度に一致するものである。また、クラミドモナスの鞭毛を用いた実験により、KIE1Bはプラス方向のモーター活性を持つことが示された。次に、我々は前述の精製したミトコンドリアをKIF1Bとインキュベートして、これが微小管上を動くかどうかをみた。KIF1Bは精製したミトコンドリア分画のvesicleを最高0.50 m/sの速度で動かした。この速度は、速い軸索内輸送の速度に一致するものである。また、クラミドモナスの鞭毛を用いた実験により、KIE1Bはプラス方向のモーター活性を持つことが示された。次に、我々は前述の精製したミトコンドリアをKIF1Bとインキュベートして、これが微小管上を動くかどうかをみた。KIF1Bは精製したミトコンドリア分画のvesicleを最高0.50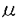 m/secのスピードで動かした。この速度は、従来報告されているin vivoでのミトコンドリアの速度とよく一致した。動いているvesicleは非常に高い純度で精製されたミトコンドリア分画のvesicleであること,及び大きさがミトコンドリアとよく一致することよりミトコンドリア自身であろうと考えられたが,DiOC6(3)によりvesicleを染色してmotility assayを行い蛍光を観察することによりこのことが確認された。なお、これらの動きはKIF1Bに対する抗体によりブロックされることも示され、その動きがKIF1B依存性であることが明らかにされた。また、コントロールに用いた他のキネシン関連蛋白によっては、ミトコンドリアの動きは観察されなかった。 m/secのスピードで動かした。この速度は、従来報告されているin vivoでのミトコンドリアの速度とよく一致した。動いているvesicleは非常に高い純度で精製されたミトコンドリア分画のvesicleであること,及び大きさがミトコンドリアとよく一致することよりミトコンドリア自身であろうと考えられたが,DiOC6(3)によりvesicleを染色してmotility assayを行い蛍光を観察することによりこのことが確認された。なお、これらの動きはKIF1Bに対する抗体によりブロックされることも示され、その動きがKIF1B依存性であることが明らかにされた。また、コントロールに用いた他のキネシン関連蛋白によっては、ミトコンドリアの動きは観察されなかった。 以上の実験結果は、ミトコンドリアの局在決定においてKIF1Bが重要な役割を果たしていることを強く示すものであり、KIF1Bはkinesin superfamilyの内、初めて運ぶオルガネラが同定されたユニクな単分子作動性順行性モーター分子であることが示された。。 |