| 1.はじめに IL-3はmulti-CSFとして知られ、コロニーアッセイにおいて、未分化な多能性血球前駆細胞及び分化した前駆細胞に働いて多種の系統のコロニーを形成する。IL-3はマウスではマスト細胞の強力な増殖因子でもある。GM-CSFは本来顆粒球とマクロファージのコロニー形成を促す因子として定義されたが、その後IL-3と多くの活性を共有することが見いだされた。IL-5は好酸球の分化増殖に重要とされるが、IL-3,GM-CSFも好酸球に対して類似の活性を持つ。これら3つのサイトカインはヒト5番染色体、マウス染色体11番に近接して存在し、活性化T細胞及びマスト細胞から分泌される。これらのサイトカインによる蛋白のリン酸化パターンは類似しており、高親和性レセプターへの結合は互いに拮抗する。 これら3つのサイトカインの類似性の一部は、これらがレセプターを共有していることから説明される。これらの高親和性レセプターは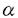 、 、 の2つのサブユニットから構成され、 の2つのサブユニットから構成され、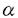 サブユニットは各サイトカインに特異的で、各サイトカインと低い親和性で結合する。ヒトにおいては共通の サブユニットは各サイトカインに特異的で、各サイトカインと低い親和性で結合する。ヒトにおいては共通の サブユニットが1つだけ存在し( サブユニットが1つだけ存在し( c)、これ単独ではサイトカインと結合しないが、 c)、これ単独ではサイトカインと結合しないが、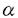 サブユニットと共に高親和性レセプターを形成する。 サブユニットと共に高親和性レセプターを形成する。 これに対してマウスでは、非常に類似した2つの サブユニットが存在し( サブユニットが存在し( c及び c及び IL3)、ヒト IL3)、ヒト cにアミノ酸レベルで56%相同である。マウス cにアミノ酸レベルで56%相同である。マウス cは,ヒトと同様にIL-3,GM-CSF,IL-5レセプターに共通する cは,ヒトと同様にIL-3,GM-CSF,IL-5レセプターに共通する サブユニットである。 サブユニットである。 IL3はマウス IL3はマウス cとアミノ酸レベルで91%相同であるにもかかわらず、GM-CSF,IL-5のレセプターには関与しない。IL-3に関しては、 cとアミノ酸レベルで91%相同であるにもかかわらず、GM-CSF,IL-5のレセプターには関与しない。IL-3に関しては、 IL3、 IL3、 cはそれぞれ、 cはそれぞれ、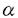 サブユニットと共同して高親和性レセプターを形成し増殖シグナルを伝達する。言い換えれば、マウスにはIL-3レセプター複合体が2種類存在することになる。これら2つの サブユニットと共同して高親和性レセプターを形成し増殖シグナルを伝達する。言い換えれば、マウスにはIL-3レセプター複合体が2種類存在することになる。これら2つの サブユニットは15番染色体上に近接して存在し、マウスとヒトが進化の過程で分岐した後に、遺伝子の増幅で生じたと考えられる。マウスが何故2つの サブユニットは15番染色体上に近接して存在し、マウスとヒトが進化の過程で分岐した後に、遺伝子の増幅で生じたと考えられる。マウスが何故2つの サブユニットを持っているのかは不明である。 サブユニットを持っているのかは不明である。 このようにIL-3,GM-CSF,IL-5はその活性の上からもレセプターの点からも興味深い系である。サイトカインは外来の異物の侵入に対する緊急時の応答に関与すると考えられるが、発生の過程及び定常状態の個体の維持にいかなる形で関与しているかは必ずしも明らかでない。これに対する解答として、各サイトカイン及び各レセプターサブユニットの欠失マウスが作成され、これらのin vivoでの役割が明らかになりつつある。 2. c及び c及び IL3欠失マウス IL3欠失マウス 筆者らは c欠失マウス及び c欠失マウス及び IL3欠失マウスを作成し、比較検討した。この2つの遺伝子は95%相同で、エクソン、イントロン構造もイントロンの配列もかなり類似していることから、作成の過程で、 IL3欠失マウスを作成し、比較検討した。この2つの遺伝子は95%相同で、エクソン、イントロン構造もイントロンの配列もかなり類似していることから、作成の過程で、 c用のターゲティングベクターで両方の相同組み換え体が得られる可能性があった。しかし実際には、 c用のターゲティングベクターで両方の相同組み換え体が得られる可能性があった。しかし実際には、 c用のターゲティングベクターでは c用のターゲティングベクターでは cのみが、 cのみが、 IL3用のターゲティングベクターでは IL3用のターゲティングベクターでは IL3のみがノックアウトされ、相同組み換えが厳密に行われることが示唆された。 IL3のみがノックアウトされ、相同組み換えが厳密に行われることが示唆された。 2種類の欠失マウスとも、外見上異常なく成長し交配能力にも異常がなかった。  c欠失骨髄細胞はGM-CSF,IL-5に全く反応せず、 c欠失骨髄細胞はGM-CSF,IL-5に全く反応せず、 cがGM-CSF,IL-5系の唯一の cがGM-CSF,IL-5系の唯一の サブユニットであることが確認された。IL-3に対しては対照群と変わりがなく、 サブユニットであることが確認された。IL-3に対しては対照群と変わりがなく、 cが存在しなくても cが存在しなくても IL3によってIL-3のシグナルは伝達されることが明らかになった。またIL-3によって少数の好酸球コロニーも形成され、in vitroではIL-5の作用なしにIL-3のみで好酸球が形成されることが示された。これに対して、 IL3によってIL-3のシグナルは伝達されることが明らかになった。またIL-3によって少数の好酸球コロニーも形成され、in vitroではIL-5の作用なしにIL-3のみで好酸球が形成されることが示された。これに対して、 IL3欠失細胞は、IL-3,GM-CSF,IL-5に全く正常に反応し、 IL3欠失細胞は、IL-3,GM-CSF,IL-5に全く正常に反応し、 IL3欠失時には IL3欠失時には cがIL-3のシグナルを伝えられることが示された。 cがIL-3のシグナルを伝えられることが示された。 組織学的には IL3欠失マウスには異常が認められなかったが、 IL3欠失マウスには異常が認められなかったが、 c欠失マウスには肺に異常(巣状に分布する肺胞内物質と気管枝、肺静脈周囲のリンパ球の浸潤)が認められた。 c欠失マウスには肺に異常(巣状に分布する肺胞内物質と気管枝、肺静脈周囲のリンパ球の浸潤)が認められた。 肺胞内物質はPAS染色で染まり、生後10週時には細胞の壊死した残骸とマクロファージを含むが、27週時には細胞成分を伴わず、肺胞蛋白症に類似した所見を呈した。リンパ球の浸潤は肺胞内物質の存在しない領域にも認められ、蛋白症に伴う二次的なものではなく c欠失による一次的なものと考えられた。これらの所見はGM-CSFの欠失マウスと類似している。さらにPAS陽性物質が肺胞マクロファージ内に認められることから、肺胞マクロファージの異常によるサーファクタントの分解の障害が考えられた。 c欠失による一次的なものと考えられた。これらの所見はGM-CSFの欠失マウスと類似している。さらにPAS陽性物質が肺胞マクロファージ内に認められることから、肺胞マクロファージの異常によるサーファクタントの分解の障害が考えられた。 血液学的には2種類のマウスともほぼ正常で、末梢血、骨髄、脾臓、腹腔細胞等に一点を除いて異常はなかった。唯一の異常は c欠失マウスに見られた末梢好酸球の減少である。これは生後4週から10週に至るまで有意に減少していた。これはGM-CSFの欠失マウスには認められていないため、おそらくIL-5のシグナルの欠失によるものと考えている。また寄生虫感染(Nippostrongylus brasiliensis)によって本来は見られる好酸球の増加は全く認められず、肺への好酸球の浸潤も見られなかった。これらは c欠失マウスに見られた末梢好酸球の減少である。これは生後4週から10週に至るまで有意に減少していた。これはGM-CSFの欠失マウスには認められていないため、おそらくIL-5のシグナルの欠失によるものと考えている。また寄生虫感染(Nippostrongylus brasiliensis)によって本来は見られる好酸球の増加は全く認められず、肺への好酸球の浸潤も見られなかった。これらは cのシグナルが、好酸球の通常の形成と感染時の急速な増加に必須であることを示している。但し、 cのシグナルが、好酸球の通常の形成と感染時の急速な増加に必須であることを示している。但し、 c欠失マウスにも少数の好酸球が存在し、寄生虫感染後、通常より非常に遅れて、肺に極く少数の好酸球が認められた。これは、上述のコロニーアッセイの結果とあわせて、 c欠失マウスにも少数の好酸球が存在し、寄生虫感染後、通常より非常に遅れて、肺に極く少数の好酸球が認められた。これは、上述のコロニーアッセイの結果とあわせて、 c以外のシグナル( c以外のシグナル( IL3の可能性もある)がある程度残っていることによると思われる。 IL3の可能性もある)がある程度残っていることによると思われる。 以上をまとめると c欠失マウスはGM-CSFとIL-5の欠失をあわせた病態を示し、IL-3に関しては c欠失マウスはGM-CSFとIL-5の欠失をあわせた病態を示し、IL-3に関しては c及び c及び IL3が重複するためにシグナルが保たれた。 IL3が重複するためにシグナルが保たれた。 c及び c及び IL3は少なくとも恒常的な造血には好酸球を除いて必須ではないことが明らかになった。また IL3は少なくとも恒常的な造血には好酸球を除いて必須ではないことが明らかになった。また cのシグナルは肺の恒常性に必要であり、その欠失は肺胞蛋白症に類似した所見を示した。 cのシグナルは肺の恒常性に必要であり、その欠失は肺胞蛋白症に類似した所見を示した。 さらに c欠失骨髄細胞を致死線量の放射線照射したマウスに移植したところ、末梢の白血球数の回復が遅延し、好酸球は減少したままであった。これは好酸球の異常が c欠失骨髄細胞を致死線量の放射線照射したマウスに移植したところ、末梢の白血球数の回復が遅延し、好酸球は減少したままであった。これは好酸球の異常が cを欠失した細胞自身によることを示すと同時に、 cを欠失した細胞自身によることを示すと同時に、 cシグナルがこのような緊急時の急速な白血球数の増加に必要であることを示している。 cシグナルがこのような緊急時の急速な白血球数の増加に必要であることを示している。 3.骨髄移植による c欠失マウスの肺病変の治癒 c欠失マウスの肺病変の治癒 組織学的検索から、肺病変の原因として肺胞マクロファージの異常が示唆された。もしこの仮定が正しく、さらに肺胞マクロファージが骨髄から由来するものならば、骨髄移植によって肺病変を操作することが可能なはずである。 c欠失マウスに致死量の放射線照射をおこない、正常の骨髄を移植したところ、移植後12週で肺病変はほぼ消失した。さらに、RAG-2遺伝子欠失細胞を c欠失マウスに致死量の放射線照射をおこない、正常の骨髄を移植したところ、移植後12週で肺病変はほぼ消失した。さらに、RAG-2遺伝子欠失細胞を c欠失マウスに移植しても、肺病変は消失した。RAG-2遺伝子を欠失する骨髄細胞はリンパ球に分化できないため、この結果はミエロイド系の細胞の関与を意味する。これらから、 c欠失マウスに移植しても、肺病変は消失した。RAG-2遺伝子を欠失する骨髄細胞はリンパ球に分化できないため、この結果はミエロイド系の細胞の関与を意味する。これらから、 c欠失マウスの肺病変は肺に存在する骨髄由来の細胞の異常によるものであり、骨髄移植によって肺病変を可逆的に治癒できることが示された。これはさらにヒト肺胞蛋白症の一部が骨髄移植によって治癒可能であることを示唆する。実際肺胞蛋白症を呈する小児の中に c欠失マウスの肺病変は肺に存在する骨髄由来の細胞の異常によるものであり、骨髄移植によって肺病変を可逆的に治癒できることが示された。これはさらにヒト肺胞蛋白症の一部が骨髄移植によって治癒可能であることを示唆する。実際肺胞蛋白症を呈する小児の中に cの異常によるものがある可能性が指摘されており、これらの患者に対する骨髄移植の是非が検討されている。 cの異常によるものがある可能性が指摘されており、これらの患者に対する骨髄移植の是非が検討されている。 |