本研究は、皮膚の機能をよりヒトの生体に近い状態で、かつ分子レベルで解析することができる方法の確立を試みたものである。 まず、ヒト由来の細胞を使用した皮膚三次元培養を行い、生体皮膚類似の組織である「皮膚モデル」作製の再現性を向上した。次いで皮膚モデルに欠損部を作成することにより、in vitroで表皮角化細胞の増殖と分化の過程を検討することのできる「創傷治癒モデル」の樹立を試みた。さらに、構成細胞の修飾操作ができるという本実験系の特長を生かして、表皮角化細胞および皮膚モデルに遺伝子導入を行い、形態形成を操作する可能性を検討した。本研究により下記の結果を得ている。 1.皮膚三次元培養および創傷治癒モデルの樹立 (1)皮膚三次元培養法の培養条件を最適化した。培地は、KGMと10%FCS添加DMEMを1:1に等量混合し、カルシウム濃度を2日間0.9mM、3日目より1.8mMとした培地を用いた。表皮角化細胞培養面の空気層への露出は4日目とし、また露出後も培地面を真皮モデルより上に設定した。以上により皮膚モデル作製が安定し再現性が向上した。 (2)皮膚三次元培養法を用いた創傷治癒モデルを樹立した。皮膚モデルの中央に欠損部を作製し、別の真皮モデル上に載せて培養を継続すると、欠損部作製直後より表皮層断端から細胞が遊走・増殖を開始した。3日目までに幅4mmの欠損部の底面を被覆し、7日間で分化・重層化した表皮層が再生した。この再生表皮層では、順次表皮角化細胞の分化マーカーが発現し、最終的に元の表皮組織構造を回復した。 再生過程の表皮角化細胞に対する増殖因子の作用を検討したところ、TGF-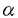 、IL-6、KGFは増殖を促進し、TGF- 、IL-6、KGFは増殖を促進し、TGF-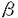 1は抑制することが明らかとなった。 1は抑制することが明らかとなった。 また三次元培養の創傷面は、単層培養の表皮角化細胞シートに新しい方法で作製した創傷面に比べて早く表皮化した。この作用には、線維芽細胞由来の液性因子及びコラーゲンゲルの要因に加え、表皮角化細胞と線維芽細胞の直接の細胞間相互作用の関与が示唆された。 II.表皮角化細胞への非増殖型アデノウイルスベクターによる遺伝子導入とその皮膚モデルの作製 (1)非増殖型アデノウイルスベクターを用いて正常表皮角化細胞へ遺伝子導入を行った。この方法による遺伝子導入効率はほぼ100%と高く、表皮角化細胞の形態および増殖に影響を及ぼさなかった。 (2)遺伝子導入を行った表皮角化細胞を用いて皮膚モデルを作製した。表皮層の形態に変化はなく、表皮層の全層で導入した遺伝子の発現が確認された。また皮膚三次元培養途中でのウイルス感染により、皮膚モデルの表皮角化細胞への遺伝子導入が可能であった。 以上、ヒトの細胞を用いた皮膚三次元培養法を用いて「皮膚モデル」および「創傷治癒モデル」を作製し、生体皮膚との類似性、創傷治癒に及ぼす増殖因子および線維芽細胞の影響を明らかにした。また、従来比較的難しいとされてきた正常表皮角化細胞への遺伝子導入が、非増殖型アデノウイルスベクターを用いることによって高い効率で行えることを示した。 本研究は、表皮角化細胞の増殖・分化の制御機構を分子レベルで解析するための新しい有力な手段を提供し、皮膚の形態形成や創傷治癒過程という高次の生命現象を分子生物学的に解析することに重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |