| 内容要旨 | | [3,3]シグマトロピー転位反応の最も単純な系であるCope転位(1)は、炭素骨格の分子内変換を引き起こすC-C結合形成反応として有用である。これにヘテロ原子を導入した系における反応はHetero-Cope転位と総称されるが、反応の進行に伴い開裂する3,4位がヘテロ原子である場合にはその結合エネルギーが小さいことから反応はより容易に進行すると考えられる。従って、N,O-divinylhydroxylamineからの転位は容易に進行すると考えられるが、不安定な反応前駆体であるため、[3,3]転位反応を進行させる系を構築することが困難であった。演者らは、ヘテロ原子間結合の開裂とエステルおよびアミドエノレートを反応系に組みむことにより、N-OおよびN-N結合の開裂により進行する[3,3]シグマトロピー転位反応(2)の新分野を開発してきた。しかし、N,O-diacyl-N-methyl-hydroxylamine、N,N’-diacyl-N,N’-dimethylhydrazineの[3,3]転位反応は、carbonyl基の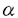 位炭素上の置換基により、反応の進行が左右されるものであった。すなわち、phenyl基,vinyl基,methylsulfenyl基等の隣接するエノレートを安定化する置換基を有する場合に限られていた。そこで、演者は芳香族[3,3]転位反応を行い、これらの転位反応の一般化を図るとともに、[3,3]転位の遷移状態に適する構造修飾により、上記の問題の解決と適用範囲の拡大を目的として研究を行った。 位炭素上の置換基により、反応の進行が左右されるものであった。すなわち、phenyl基,vinyl基,methylsulfenyl基等の隣接するエノレートを安定化する置換基を有する場合に限られていた。そこで、演者は芳香族[3,3]転位反応を行い、これらの転位反応の一般化を図るとともに、[3,3]転位の遷移状態に適する構造修飾により、上記の問題の解決と適用範囲の拡大を目的として研究を行った。 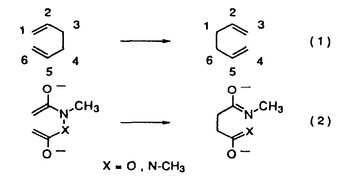 1.塩基性条件下、芳香族ヒドラジンの転位反応 ヒドラジンのN-N結合の開裂による[3,3]転位反応はFisherのインドール合成がその代表例であるが、それらは強酸性条件下における芳香族ヒドラゾンのエンーヒドラジンを中間体とする反応である。演者は芳香族ヒドラジンのアシル体の塩基性条件下における反応を行った。 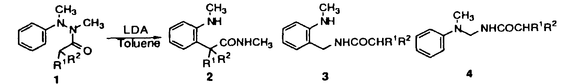 N,N’-dimethylphenylhydrazineのアシル体1(a:R1=Ph,R2=H;b:R1=R2=H)はToluene中、LDA、室温の条件下、アミドエノレートを生成し、[3,3]転位体2を与えた(a:86%;b:54%)。しかしながら3級のアシル体1c(R1=R2=CH3)では、[3,3]転位体2cは生成せず、Sommelet-Hauser型の転位体3c(26%)、stevens型の転位体4c(14%)が生成した。ここでは、目的の[3,3]転位反応が1級および2級のアシル体において反応点における置換基の種類によらず進行することと、ヒドラジンの系において新規であるSommelet-Hauser転位、Stevens転位が進行することが見い出された。 2.[3,3]シグマトロピー転位反応における3,4位置換基による反応制御2-1.ヒドロキシルアミン-ジアシル体の[3,3]転位反応 N,O-diacetyl-N-methylhydroxylamine 5aについてTHF中、2.5等量のBase、-78℃、2時間の条件で反応を行い、ジアゾメタンでエステル化した後生成物を単離しようとしたが、目的の[3,3]転位体6aは得られなかった。それに対し、N-置換基をイソプロピル基,t-ブチル基とかさ高くしていくとN,O-diacetylhydroxylamineにおいても[3,3]転位体が得られた。また、2級のアシル体の場合にも、置換基の種類によらず、反応収率は向上した。 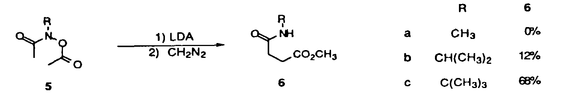 これらの結果はN-置換基の立体効果により結合生成を起こす炭素原子同士が空間的に近くに位置し、反応が進行しやすくなるからであると考えられる。このようにN-置換基の立体効果により、[3,3]転位反応の適用範囲を拡大することができた。 2-2.ヒドロキシルアミン-O-カルバメートの[3,3]転位反応 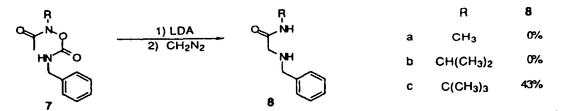 2-1と同様の窒素原子上の置換基効果はN-acyl-N-alkylhydroxylamine-O-carbamate 7の反応においても認められた。N-acetyl-hydroxylamine-O-benzylcarbamate 7a,bはTHF中、LDA存在下、目的の[3,3]転位体8a,bを与えないが、N-t-ブチル基を有する7cでは[3,3]転位の後に脱炭酸した8cが得られた。また、2級のアシル体の場合にも、置換基の種類によらず、反応収率は向上し、カルボン酸 位への協奏的アミノ化反応として応用が可能となった。 位への協奏的アミノ化反応として応用が可能となった。 2-3.ジフェニルヒドラジン-ジアシル体の[3,3]転位反応 N,N’-diphenylhydrazineのジアシル体9はLDA存在下、室温以下で2つのアミドエノレートの[3,3]転位反応から10を、アミドエノレートと芳香環の[3,3]転位反応から11を与えた。 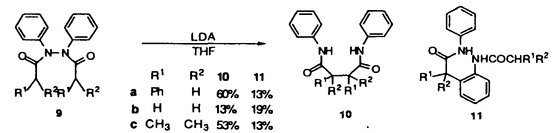 10と11の生成比は置換基や反応溶媒により大きく異なる。ここでは3級のアシル体9cにおいても[3,3]転位体が生成し、反応点における置換の種類によらず[3,3]転位が進行することで系の適応範囲が拡大されている。これは2-1と同様、ヒドラジンのN-置換基の立体効果によるものであると考えられる。 2-4.環状ヒドラジン-ジアシル体の[3,3]転位反応 環状ヒドラジン-ジフェニルアセチル体12はTHF溶液中、3.0等量LDA存在下、50℃、3時間の条件下、ジアミドエノレートを生成し、[3,3]転位体13を与えた。  また7員環ヒドラジン-ジアシル体14は[3,3]転位体15を与えるが、N,N’-di-methylhydrazineのジアシル体16は[3,3]転位体17を生成しない。 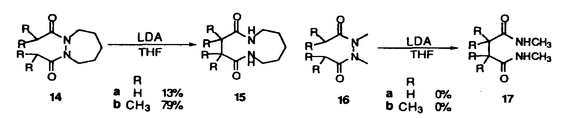 これらの結果は、環状ヒドラジンを用いることにより反応点における置換の種類によらず本反応が応用できることを示している。 3.[3,5]シグマトロピー転位反応 O-phenylacetyl-N-methylthioacetyl-N-methylhydroxylamine 18aについて2.5当量のKHMDS、THF中、-78℃、2時間の条件で反応を行い、ジアゾメタンでエステル化した後、生成物を単離すると[3,3]転位体19aとともにフェニル酢酸誘導体20aが得られた。 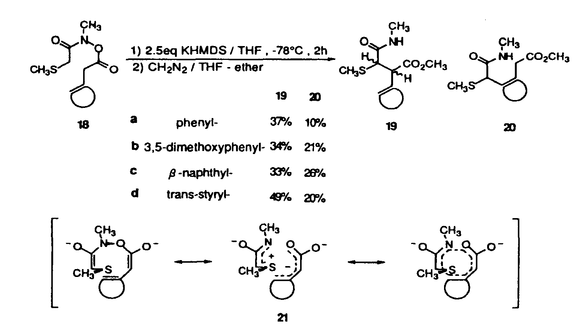 20aは通常のシグマトロピー反応では予想されない[3,5]転位生成物である。[3,5]転位生成物は、アミド 位の置換基としてスルフェニル基を用いた場合にのみ得られる。エステル側の反応点の電子密度が高いほど[3,5]転位生成物の生成比が増加することから、近接イオン対の性質を持つ遷移状態が支持される。また置換基として 位の置換基としてスルフェニル基を用いた場合にのみ得られる。エステル側の反応点の電子密度が高いほど[3,5]転位生成物の生成比が増加することから、近接イオン対の性質を持つ遷移状態が支持される。また置換基として -ナフチル基を用いた時に異性体として得られた[3,5]転位生成物の立体構造からE型ジエノレート21が反応中間体であることがわかる。スルフェニル基はN側の求電子的部分構造を安定化する効果があり、これがO側の求核的部分構造と反応するものと考えられる。 -ナフチル基を用いた時に異性体として得られた[3,5]転位生成物の立体構造からE型ジエノレート21が反応中間体であることがわかる。スルフェニル基はN側の求電子的部分構造を安定化する効果があり、これがO側の求核的部分構造と反応するものと考えられる。 以上のように、演者はヘテロ原子間結合の開裂による[3,3]転位反応を体系化するとともに、同結合の開裂による異種の反応が起こることを見い出した。この分野の一般化は有機化学における基礎反応としての意義に加え、合成化学においても技術的展開をもたらすものであろう。 ref.1)T.Uchida,Y.Endo,S.Hizatate,K.Shudo,Chem.Pharm.Bull.1994,42(2),419 2)Y.Endo,T.Uchida,S.Hizatate,K.Shudo,Synthesis 1994,1096 |
| 審査要旨 | | 内田は、ヘテロ原子間結合の開裂とエステルおよびアミドエノレートを反応系に組み込むことにより、N-OおよびN-N結合の開裂により進行する[3,3]シグマトロピー転位反応の新分野を開発し、この反応の遷移状態に適する構造修飾による適用範囲の拡大を果たした。 塩基性条件下、芳香族ヒドラジンの転位反応ではN,N’-diacyl-N,N’-dimethylphenyl-hydrazine1を反応前駆体として用い、目的の[3,3]転位体2が1級および2級のアシル体において反応点における置換基の種類によらず得られること、3級のアシル体においてSommelet-Hauser転位、Stevens転位に類する反応が進行し、各転位体3,4が得られることが見い出された。 ヒドロキシルアミン、ヒドラジンのジアシル体の反応系では、窒素原子上に適当な置換基を導入することにより[3,3]転位反応を高収率で進行させることができた。 N,N’-diacyl-N,N’-dimethylhydrazineは[3,3]転位体を生成しないが、7員環のジアシルヒドラジン7は[3,3]転位体8を与えた。環状ヒドラジンを用いることにより反応点における置換の種類によらず、本反応は広く応用できる。 N,O-diacyl-N-alkylhydroxylamineの反応系において通常のシグマトロピー反応では予想されない[3,5]転位体11が得られた。[3,5]転位反応は、アミド 位の置換基としてスルフェニル基を用いた場合にのみ進行し、E型ジエノレートの反応中間体、近接イオン対の性質を持つ遷移状態を経て進行する反応であることが示された。 位の置換基としてスルフェニル基を用いた場合にのみ進行し、E型ジエノレートの反応中間体、近接イオン対の性質を持つ遷移状態を経て進行する反応であることが示された。 以上のように、内田はヘテロ原子間結合の開裂による[3,3]転位反応を体系化するとともに、同結合の開裂による新規の反応を見い出し、その性質を明らかにした。 この研究成果は有機化学に新しい一般反応を築くものであり、博士(薬学)の学位にふさわしいと判断する。 |